
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
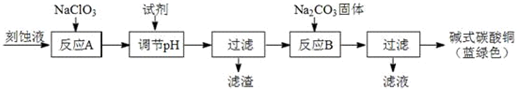
分析 (1)①工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备碱式碳酸铜,流程分析,加入氯酸钠的作用是氧化剂作用,氧化亚铁离子为铁离子易于除去;
②依据图表数据分析,铁离子全部沉淀,铜离子不沉淀的PH范围为3.2-4.2;
③检验洗涤是否干净,设计实验检验滤液中是否含有氯离子证明是否洗涤干净;
④蓝绿色产品中混有CuO杂质可能的元婴是氢氧化铜咋温度较高会发生分解生成氧化铜;
(2)铁离子的浓度小于1×10-5mol•L-1时就认为沉淀完全,则c(OH- )=$\root{3}{\frac{Ksp[Fe(OH)_{3}]}{c(F{e}^{3+})}}$,再根据水的离子积常数计算溶液的氢离子浓度,从而确定其pH.
解答 解:(1)①工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备碱式碳酸铜,流程分析,加入氯酸钠的作用是氧化剂作用,氧化亚铁离子为铁离子,调节溶液PH易于把铁离子沉淀除去,
故答案为:将Fe2+氧化成Fe3+并最终除去;
②流程分析可知,分离除杂的方法是通过调节溶液PH大于3.2,小于4.2,使铁离子全部沉淀完全,铜离子不沉淀,达到分离的目的,故答案为:3.2-4.2;
③沉淀表面会含有氯化钠溶液,设计实验检验是否含有氯离子的方法可以检验是否洗涤干净,实验设计为:取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净,故答案为:取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净;
④造成蓝绿色产品中混有CuO杂质的原因是B步骤温度过高,生成氢氧化铜会分解生成氧化铜,故答案为:反应B的温度过高;
(2):(1)铁离子的浓度小于1×10-5mol•L-1时就认为沉淀完全,则c(OH- )=$\root{3}{\frac{Ksp[Fe(OH)_{3}]}{c(F{e}^{3+})}}$=$\root{3}{\frac{8×1{0}^{-38}}{1×1{0}^{-5}}}$=2×10-11mol/L,c(H+)=$\frac{1{0}^{14}}{2×1{0}^{-11}}$mol/L=5×10-4mol/L,pH=-lg5×10-4=3.3,故答案为:3.3.
点评 本题考查了实验探究物质分离方法和物质性质的分析判断和难溶电解质的溶解平衡,Ksp的计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 通入足量的酸性KMnO4溶液 | B. | 在Ni催化、加热条件下通入H2 | ||
| C. | 通过足量的溴水 | D. | 通过足量的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R | |
| B. | M和T形成的化合物既能与强酸反应又能与强碱反应 | |
| C. | 单质与等浓度的稀盐酸反应的剧烈程度为Q>L | |
| D. | L2+与R2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )所示,该单质与NaOH溶液反应时产物之一为Na2SO3,写出该反应的离子方程式:3S8+48OH-=16S2-+8SO32-+24H2O.
)所示,该单质与NaOH溶液反应时产物之一为Na2SO3,写出该反应的离子方程式:3S8+48OH-=16S2-+8SO32-+24H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A→B | B. | B→C | C. | C→D | D. | D→E |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
| A. | R的氧化物对应的水化物可能具有两性 | |
| B. | 离子半径大小:r(M3+)>r(T2-) | |
| C. | X单质在氧气中燃烧生成XO3 | |
| D. | L、X形成的简单离子核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com