
【题目】已知:2SO2(g) + O2(g)2SO3(g) ΔH ,不同条件下反应过程能量变化如图所示。下列说法中不正确的是

A.反应的 ΔH<0
B.过程b 使用了催化剂
C.过程b 发生两步反应,第一步为吸热反应
D.使用催化剂可以降低反应活化能,提高 SO2 的平衡转化率
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】有机物A、B、C、D、E能发生如图所示的转化(![]() 为乙炔)。
为乙炔)。
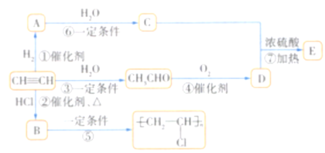
已知:![]() ,
,![]()
![]() ,
,![]() 。
。
请回答下列问题:
(1)写出A、B、C、D、E的化学名称:A________,B________,C________,D________,E________。
(2)反应②的反应类型为________。
(3)反应⑤的产物在日常生活中常用于制作购物袋,但不能用于制作食品保鲜袋,其原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 铜镁合金完全溶解于
铜镁合金完全溶解于![]() 、密度为
、密度为![]() 、质量分数为
、质量分数为![]() 的浓硝酸中,得到
的浓硝酸中,得到![]() 气体
气体![]() 标准状况
标准状况![]() ,向反应后的溶液中加入适量的
,向反应后的溶液中加入适量的![]() 溶液,恰使溶液中的金属离子全部沉淀,下列说法不正确的是
溶液,恰使溶液中的金属离子全部沉淀,下列说法不正确的是![]()
![]()
A.该浓硝酸中HNO3的物质的量浓度是14 mol/L
B.加入NaOH溶液的体积是160 mL
C.起氧化性的硝酸的物质的量为0.16 mol
D.得到的金属氢氧化物的沉淀为6.24 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在 2 L 的密闭容器中,X、Y、Z 三种物质的物质的量随时间的变化曲线如图所示。
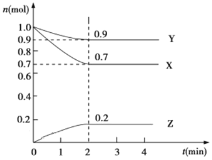
(1)反应从开始至 2 分钟末,Y 的转化率为α(Y)=_______________。
(2)由图中所给数据进行分析,该反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是

A. 正极电极反应式为:2H++2e—→H2↑
B. 此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C. 此过程中铜并不被腐蚀
D. 此过程中电子从Fe移向Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 四种元素,前三种元素的简单离子都和氖原子具有相同的核外电子排布。
四种元素,前三种元素的简单离子都和氖原子具有相同的核外电子排布。![]() 元素没有正化合价;
元素没有正化合价;![]() 的氢化物的分子式为
的氢化物的分子式为![]() ,
,![]() 的
的![]() 的单质能从足量酸溶液中置换出
的单质能从足量酸溶液中置换出![]() (标准状况);
(标准状况);![]() 的原子核中没有中子。
的原子核中没有中子。
(1)根据以上条件,推断![]() 、
、![]() 、
、![]() 、
、![]() 的元素名称。
的元素名称。
A________,B ________,C ________,D ________。
(2)用电子式表示![]() 与
与![]() 、
、![]() 与
与![]() 、
、![]() 与
与![]() 相互结合成的化合物,指出其化合物的类型及所含化学键类型。
相互结合成的化合物,指出其化合物的类型及所含化学键类型。
化合物 | 电子式 | 化合物类型 | 化学键类型 |
| _____ | _____ | _____ |
| _____ | _____ | _____ |
B+D | ____ | _____ | _____ |
(3)写出![]() 与
与![]() 所形成的化合物和
所形成的化合物和![]() 与
与![]() 所形成的化合物反应的离子方程式:_______。
所形成的化合物反应的离子方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图完成一氧化氮与过氧化钠反应制备亚硝酸钠(2NO+Na2O2=2NaNO2,2NO2+Na2O2=2NaNO3,NO能被酸性KMnO4溶液氧化为NO3-),下列说法错误的是

A.检查装置气密性后,应先打开止水夹,从导管中通入N2
B.装置C是用来吸收CO2的
C.D管中可能含有的杂质为NaNO3、NaOH
D.装置E用于处理尾气,反应中氧化剂与还原剂的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究反应过程的热量变化对于生产生活有重要意义。
Ⅰ.甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在一定条件下合成甲醇。请按要求回答下列问题:
(1)反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)在使用和未使用催化剂时,反应过程和能量的对应关系如图所示。下列说法正确的是___(填字母代号)。
CH3OH(g)+H2O(g)在使用和未使用催化剂时,反应过程和能量的对应关系如图所示。下列说法正确的是___(填字母代号)。

A.该可逆反应的正反应为吸热反应
B.断裂反应物中的化学键所吸收的总能量小于形成生成物中的化学键所释放的总能量
C.曲线b是使用了催化剂对应的曲线,且加入催化剂后,反应热变小
(2)CO、CO2和H2在合成过程中发生的主要反应如下:
①CO(g)+2H2(g) ![]() CH3OH(g) ΔH1=-99 kJ·mol-1
CH3OH(g) ΔH1=-99 kJ·mol-1
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
则ΔH3=____。
(3)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:

则通入a气体的电极是电池的____(填“正”或“负”)极,其电极反应式为___。
Ⅱ.已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态下,有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如图所示:
![]()
(1)在一定温度下,测得硫蒸气的平均摩尔质量为80 g·mol-1,则该蒸气中S2的体积分数不小于_____。
(2)若已知硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,S(s)+O2(g)===SO2(g)ΔH=-a kJ·mol-1,则S8中硫硫键的键能为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据(已知![]() 为阿伏伽德罗常数的值):
为阿伏伽德罗常数的值):
试管中所加试剂及其用量/mL | 溶液退至无色所需时间/min | |||||
实验编号 | 实验温度/℃ | 0.6 mol/LH2C2O4溶液 | H2O | 3 mol/LH2SO4溶液 | 0.05 mol/LKMnO4溶液 | |
① | 25 | 3.0 | v1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | v2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式:___,当该反应以实验①中数据反应完全时转移电子数为_____![]() 。
。
(2)实验①②是探究浓度对反应速率的影响,实验②③时探究温度对反应速率的影响,则表中V1=_______,V2=__________。
(3)根据实验①、②的数据,可以得到的结论是____。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。

该小组同学根据上述信息提出了新的假设,并设计一下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量/ml | 再加入某种固体 | 溶液退至无色所需时间/min | |||
0.6 mol/LH2C2O4溶液 | H2O | 3 mol/LH2SO4溶液 | 0.05 mol/L KMnO4 溶液 | ||||
④ | 25 | 3.0 | 2.0 | 2.0 | 3.0 | MnSO4 | t |
①该小组同学提出的新假设是__________。
②若该小组同学提出的假设成立,应观察到__________(填实验现象)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com