
科目:高中化学 来源: 题型:解答题
 H++OH-、HCO3-+H2O
H++OH-、HCO3-+H2O +H2CO3+OH-、HCO3-+H2O
+H2CO3+OH-、HCO3-+H2O H3O++CO32-
H3O++CO32- 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅②③④⑤⑥⑧ | B. | 仅③⑤⑥⑧ | C. | 仅①②④⑦ | D. | 除①外 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
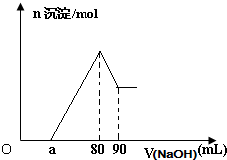 将一块镁铝合金投入一定体积的1mol/L稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图.下列说法中不正确的是( )
将一块镁铝合金投入一定体积的1mol/L稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图.下列说法中不正确的是( )| A. | 由图可以确定该镁铝合金中铝的质量为0.27 g | |
| B. | 由图可以确定该合金中两元素的物质量之比的最大值为4 | |
| C. | 当滴入1mol/L的NaOH溶液85mL时,所得沉淀的成分为Mg(OH)2和Al(OH)3 | |
| D. | 由图可以确定a的取值范围为:0≤a≤50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
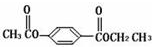
| A. | 苯甲酸共有四个同分异构体(含苯环且包括苯甲酸) | |
| B. | 相同条件下的沸点:乙二醇>乙醇>乙烷>甲烷 | |
| C. | CH3COOCH3在核磁共振氢谱中有两种不同类型的氢原子 | |
| D. | 两种不同的氨基酸在缩聚反应时可生成不少于4种的聚合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据体系的稳定性,可将分散系分为溶液、胶体和浊液 | |
| B. | 一种分散系的分散质可以是固态、液态或气态,但只能是纯净物 | |
| C. | 利用丁达尔效应可以区分溶液和胶体,它利用了光的衍射原理 | |
| D. | 火力发电厂的烟气管道里安装的静电除尘装置,它利用了胶体的电泳原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,A的晶体类型离子晶体.
,A的晶体类型离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应 Na+H2O═Na++OH-+H2↑ | |
| B. | 碳酸钠与稀硫酸反应CO32-+2H+═CO2↑+H2O | |
| C. | 氢氧化铜与稀硫酸反应OH-+H+═H2O | |
| D. | 铁与盐酸反应2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
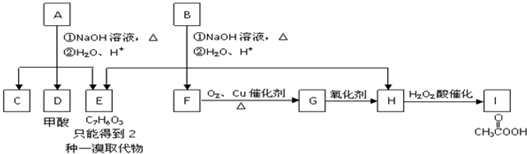
 $\stackrel{NaOH溶液,△}{→}$CH3COONa+
$\stackrel{NaOH溶液,△}{→}$CH3COONa+ -ONa)
-ONa)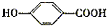 .
. 或
或 .
. ,反应类型是消去反应.
,反应类型是消去反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com