
【题目】能用离子方程式H++OH-=H2O表示的反应是
A. 稀醋酸和稀氨水反应 B. 稀硫酸和烧碱溶液反应
C. 稀盐酸和氢氧化铜反应 D. 稀硫酸和氢氧化钡溶液反应
科目:高中化学 来源: 题型:
【题目】有NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应:①若所含溶质的物质的量相等,则生成沉淀的物质的量之比是;②若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量之比是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同学们在实验室里用废铁屑(含少量铜)制取FeCl3·6H2O的流程如下。
请回答下列问题。
(1)固体中加入过量稀盐酸时的现象是。
(2)溶液中通入Cl2时发生反应的化学方程式是,反应中Cl2表现出的性质是,此处的Cl2也可以用代替(填序号)。
A.H2O2 B.SO2 C.浓硫酸
(3)上述流程中由浓缩后的溶液获取FeCl3·6H2O的操作包括、过滤、洗涤。
(4)用FeCl3溶液制备Fe2O3 , 可向FeCl3溶液中滴加足量 , 然后过滤、洗涤、 , 即可得到Fe2O3。
(5)FeCl3溶液能用作印制电路铜板的腐蚀液,FeCl3溶液与铜反应的离子方程式是,反应一段时间后,取少量腐蚀液,向其中滴加 , 观察到 , 证明腐蚀液中任含Fe3+。此时腐蚀液中的金属阳离子是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl﹣)>c(CH3COO﹣)>c(OH﹣)
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3H2O)>c(NH4+)>c(Cl﹣)>c(OH﹣)
C.0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合: ![]() c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42﹣)+c(HC2O4﹣)+c(OH﹣)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32﹣、SO32﹣、SO42﹣、Cl﹣中的若干种,现取X溶液进行连续实验,实验过程及产物如下:下列说法正确的是( )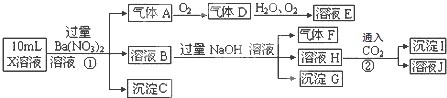
A.X中肯定存在Fe2+、NH4+、SO42﹣
B.溶液E和气体F不能发生化学反应
C.X中肯定不存在CO32﹣、SO32﹣、Cl﹣
D.沉淀I是Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一. 
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:
2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)△H>0.
①写出该反应的平衡常数表达式 .
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 .
A.容器中密度不变 B.单位时间内消耗2molCO2 , 同时消耗1mol二甲醚
C.v(CO2):v(H2)=1:3 D.容器内压强保持不变
(2)汽车尾气净化的主要原理为:2NO(g)+2CO(g) ![]() 2CO2(g)+N2 (g)
2CO2(g)+N2 (g)
在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.据此判断:
①该反应的△H0(选填“>”、“<”).
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2 , 在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线 .
(3)已知:CO(g)+2H2(g)CH3OH(g)△H=﹣a kJmol﹣1 .
①经测定不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4molL﹣1、c(H2)=0.4molL﹣1、c(CH3OH)=0.8molL﹣1 , 则此时v正v逆(填“>”、“<”或“=”).
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
达到平衡时CO的转化率为 .
(4)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势.氨在燃烧实验中相关的反应有:
4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H1 ①
4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H2 ②
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H3 ③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= .
(5)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置为用铂作为电极,加入KOH电解质溶液中,其电池反应为 4NH3+3O2=2N2+6H2O,写出该燃料电池的正极反应式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,有关说法正确的是( )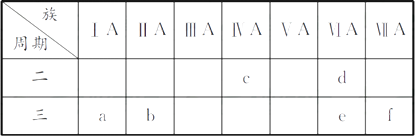
A.e的氢化物比d的氢化物稳定
B.a、b、e三种元素的原子半径:e>b>a
C.六种元素中,c元素单质的化学性质最活泼
D.c、e、f的最高价氧化物对应的水化物的酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,![]()
其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的原子结构示意图为。
(2)元素的非金属性为(原子的得电子能力):QW(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种氧化物,其中一种是气体,反应的化学方程式为。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com