
用NA表示阿佛加德罗常数,下列说法正确的是( )
A. 300 mL 2 mol·L-1的蔗糖溶液中所含分子数为0.6NA
B. 在标准状况下,2.8g N2和2.8g CO所含电子数不相等
C. 0.2 mol H2O2完全分解转移的电子数为0.2NA
D.在常温常压下,2.24L SO2与O2的混合气体中所含氧原子数为0.2NA
科目:高中化学 来源: 题型:
某离子晶体晶胞结构如下图所示,x位于立方体的顶点,Y位于立方体中心。试分析:
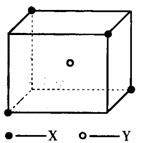 (1)晶体中每个Y同时吸引着__________个X,每个x同时
(1)晶体中每个Y同时吸引着__________个X,每个x同时
吸引着__________个Y,该晶体的化学式为__________ 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有
__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹∠XYX的
度数为__________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ·cm-3,阿伏加德罗常数为NA则晶体中两个距离最近的X中心间的距离为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
镁是一种重要的金属资源,工业上制取镁单质主要是电解法。
(1)电解法制取镁单质的反应方程式是:______________________________。
(2)电解原料无水氯化镁可由海水制备。主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩冷却结晶。
其步骤先后顺序是__________________________________;(每步骤可重复使用)
(3)上述步骤①中“一定条件下”具体是指:_______________________________,其目的是___________________________________________。
(4)已知某温度下Mg(OH)2的Ksp=6.4×l0−12,当溶液中c(Mg2+)≤1.0×10−5mol·L−1可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥_________________ mol·L−1。
(5)饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,看到的现象是___________。反应原理可能有两方面,请分别用离子方程式表示:
①________________________________________________;
②________________________________________________。
要验证①②谁是Mg(OH)2溶解的主要原因,可选取________代替NH4Cl溶液作对照实验。
A.NH4NO3 B.(NH4)2SO4 C.CH3COONH4 D.NH4HCO3
(6)镁电池是近年来科学技术研究的热点之一。一种“镁—次氯酸盐”电池的总反应为:
Mg + ClO- + H2O == Mg(OH)2 + Cl- 。其工作时正极的电极反应式:_________________;用此镁电池给铅蓄电池充电,下列说法中正确的是______________________________。
A.镁电池正极与铅蓄电池正极相连
B.电子从Pb电极转移到镁电池负极
C.充电后,铅蓄电池两极质量均减小,理论上镁电池消耗24 g Mg,阴、阳极的质量变化之比为3︰2
D.充电后,镁电池和铅蓄电池的pH均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
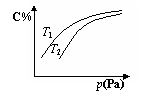
在密闭容器中,对于可逆反应A +3B  2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
A.若正反应方向△H <0,则T1> T 2
B.压强增大时,混合气体的平均相对分子质量减小
C.A一定为气体
D.B一定为气体
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)钠镁铝三种元素中第一电离能最大的是 (填元素名称)。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。
(3)微粒间存在非极性键、配位键、氢键及范德华力的是 。
A. NH4Cl晶体 B. Na3AlF6晶体 C. Na2CO3•10H2O晶体
D. CuSO4溶液 E. CH3COOH溶液
(4)部分共价键键能数据如下表:
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 159 | 418 | 945 |
根据上表数据推算并写出氨气分解为氮气和氢气的热化学方程式:
。
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4 °C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
乙醇和二甲醚沸点及水溶性差异的主要原因是 。
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式 。
(7)石墨烯的应用为电子行业的发展带来了重大的突破,其结构可以看作是单层的石墨,其中碳原子的杂化方式为 ;C60的晶体结构类似于干冰,则每个C60晶胞的质量为 (用含NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关热化学方程式的叙述不正确的是( )
A.已知2H2(g)+O2(g)= 2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
B.已知C(石墨,s)= C(金刚石,s);△H>0,则石墨比金刚石稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4 kJ/mol
D.已知2C(s)+2O2(g)=2CO2(g);△H1,2C(s)+O2(g)=2CO(g) ;△H2。则△H1<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
某一离子反应体系有反应物和产物共以下六种:
MnO4-、H+、O2、H2O、H2O2、Mn2+,
已知该反应中的H2O2只发生如下过程: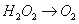
(1)该反应中的还原剂是 ,还原产物是________。
(2)KMnO4溶液随着酸性的增强氧化性不断增强,应选择_______(选填“稀硫酸”或“浓盐酸”)进行KMnO4溶液的酸化。
(3)假如反应转移了0.3mol电子,则产生的气体在标准状况下体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列说法不正确的是( )
A.64 g氧气中含氧分子数为2NA
B.1.7 g OH-中所含的电子数为NA
C.49 g硫酸中所含氧原子数为2NA
D.58.5 g氯化钠中所含的离子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在化学学习中使用数轴的表示方法可收到直观、形象的效果,下列表达中正确的是( )
A.分散质微粒的大小与分散系种类的关系:
B.常温下溶液的pH其酸碱性的关系:
C.硫的化合物中化合价与其氧化性、还原性的关系:
D.Fe在Cl2中燃烧的产物与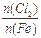 的关系:
的关系: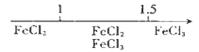
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com