
| A. | Fe | B. | 活性炭 | C. | 硫酸亚铁 | D. | 氯化钠 |
分析 回收含有Ag+的废水中的贵重金属Ag,加入的物质需将银离子还原成银单质,铁能置换出银,活性炭、硫酸亚铁、氯化钠与银离子都不反应,据此分析解答.
解答 解:A.银排在铁的后面,加入铁可以与Ag+反应生成银从而回收银,故A正确;
B.活性炭疏松多孔的结构,具有吸附性,不能与Ag+反应,故不能回收Ag,故B错误;
C.硫酸亚铁中为+2价,不能还原银离子,与Ag+不反应,故不能回收Ag,故C错误;
D.氯化钠中钠离子没有还原性,不能还原银离子,氯化钠与Ag+不反应,故不能回收Ag,故D错误;
故选A.
点评 本题考查了废水的处理,要注意所加的试剂能与Ag+反应且置换出银的原则,题目较简单.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | N | O | F | |||||
| 3 | Na | Si | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硝酸钠、NaNO2、盐 | B. | 氧化铁、FeO、氧化物 | ||
| C. | 纯碱、Na2CO3、碱 | D. | 酒精、CH3CH2OH、有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳酸的酸性比硅酸强 | |
| B. | 136C表示该元素的相对原子质量近似为13,核电荷数为6 | |
| C. | 共价键必然存在于共价化合物中 | |
| D. | X、Y+、Z-三种粒子的电子层结构相同,则其质子数一定不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


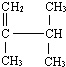 2,3-二甲基-1-丁烯(用系统命名法命名)
2,3-二甲基-1-丁烯(用系统命名法命名)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度可以加快反应速率 | |
| B. | 使用合适的催化剂可以加快反应的速率 | |
| C. | 在上述条件下,氢气能全部转化为氨气 | |
| D. | 达到平衡时,体系中各物质的浓度一定相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com