
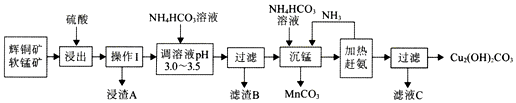
分析 流程分析可知辉铜矿软锰矿加入硫酸酸浸:Cu2S+2MnO2+8H+=Cu2++S+2Mn2++4H2O、Fe2O3+6H+=2Fe3++3H2O,SiO2不溶,过滤得到浸渣A为S、SiO2,得到浸出液调节溶液PH,使铁离子全部沉淀,滤渣B为氢氧化铁,过滤得到浸出液中主要含有CuSO4、MnSO4等,加入碳酸氢铵和氨水过滤得到混合溶液加热赶出氨气结晶析出得到碱式碳酸铜,滤渣为碳酸锰,通过蒸发浓缩,冷却结晶过滤洗涤干燥得到硫酸氨晶体,据此分析作答.
解答 解:(1)浸出前需要先将矿石粉碎,增大与酸的接触面积,加快反应速率(或提高浸出效率);
故答案为:增大与酸的接触面积,加快反应速率(或提高浸出效率);
(2)浸出时,二氧化锰有氧化性,将Cu2S氧化生成铜离子和硫单质,反应为:Cu2S+2MnO2+8H+=Cu2++S+2Mn2++4H2O;
故答案为:Cu2S+2MnO2+8H+=Cu2++S+2Mn2++4H2O;
(3)浸出时,二氧化锰不溶,生成的硫单质不溶,故浸渣A为SiO2、S;调溶液pH 3.0-3.5,将Fe3+以氢氧化物的形式除去; 室温下,Kap[Fe(OH)3]=4.0×10-38mol/L,c(Fe3+)=4.0×10-8mol/L,则c(OH-)=$\root{3}{\frac{4.0×1{0}^{-38}}{4.0×1{0}^{-8}}}$=10-10mol/L,则c(H+)=10-4mol/L,pH=4;
故答案为:SiO2、S;Fe3+;4;
(4)MnCO3在空气中受热制取MnO2,反应为:2MnCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2MnO2+2CO2;
故答案为:2MnCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2MnO2+2CO2;
(5)滤液C经过蒸发浓缩,冷却结晶过滤洗涤干燥得到晶体;
故答案为:蒸发浓缩 冷却结晶;
(6)与火法冶炼辉铜矿相比,用图中方法冶炼辉铜矿实现资源的综合利用、不产生污染环境的气体、能耗低等;
故答案为:实现资源的综合利用、不产生污染环境的气体、能耗低等.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、溶度积的计算等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应KClO3+6HCl═3C12↑+KCl+3H2O,每生成1.5molC12转移电子数为2.5NA | |
| B. | 标准状况下,11.2LNO与11.2LO2混合后所含分子数为0.75NA | |
| C. | 1L0.1mol/LNH4Cl溶液中NH4+的数目为0.1NA | |
| D. | 40gSiC中含有Si-C键的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净的苯酚是粉红色的晶体,65℃以上时能与水互溶 | |
| B. | 苯酚是生产电木的单体之一,与甲醛发生缩聚反应 | |
| C. | 苯酚比苯更易发生苯环上的取代反应 | |
| D. | 苯酚有毒,也能配制洗涤剂和软药膏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质(杂质) | 所用试剂 | 分离方法 |
| A | 甲烷(乙烯) | 溴水 | 洗气 |
| B | 氢氧化钠溶液(氢氧化钙溶液) | 二氧化碳 | 过滤 |
| C | 乙烯(SO2) | 酸性KMnO4 | 洗气 |
| D | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火 | |
| B. | 探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏低 | |
| C. | 滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 | |
| D. | 为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管滴加蒸馏水至刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com