
| A.没有沉淀物生成 |
| B.只有氢氧化铝沉淀生成 |
| C.只有氢氧化镁沉淀生成 |
| D.有氢氧化铝和氢氧化镁沉淀生成 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3+具有氧化性,Fe2+具有还原性 |
| B.Fe3+的水溶液呈红褐色,Fe2+的水溶液呈浅绿色 |
| C.Fe2+的溶液中滴入强碱溶液,立即出现红褐色沉淀 |
| D.铁粉可以和水蒸气在高温下反应生成Fe2O3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.W1>W2>W3 | B.W1=W2=W3 | C.W3>W1>W2 | D.W3>W2>W1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.空气 | B.二氧化碳 | C.氮气 | D.氩气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
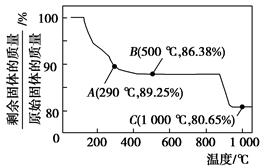
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.良好的导电性 |
| B.高温下能分解,吸收热量 |
| C.密度大,能增大飞船的惯性 |
| D.硬度大,机械性能好 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.工业上金属铈一般应低温密封保存 |
| B.工业上不能采取用H2还原氧化铈的方法冶炼金属铈 |
| C.工业上可以采用电解氯化铈水溶液米获得铈单质 |
| D.铈溶于氢碘酸的主要化学方程式可表示为:2Ce+6HI=2CeI3+3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com