
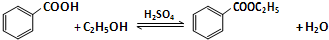
| 物质 | 颜色状态 | 密度/g/cm3 | 熔点/℃ | 沸点/℃ |
| 苯甲酸 | 白色固体 | 1.2659 | 122 | 249 |
| 苯甲酸乙酯 | 无色液体 | 1.05 | -34.6 | 212.6 |
| 乙酸 | 无色液体 | 1.0492 | 16.6 | 117.9 |
| 乙醇 | 无色液体 | 0.789 | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | 0.894-0.898 | -83.6 | 77.1 |
| 乙醚 | 无色液体 | 0.713 | -116.3 | 34.6 |
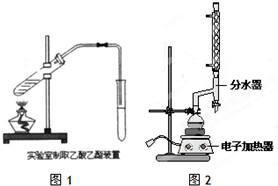
分析 (1)①与酸混合时,将密度大的液体注入密度小的液体中,混合浓硫酸和乙醇时,应将浓硫酸慢慢注入到乙醇中,并不断搅拌,使产生的热量及时散失;
②乙酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
③随着乙酸乙酯的蒸出,红色会变浅,但是无气体产生,是因为碳酸钠与醋酸反应生成碳酸氢根离子,酸性减弱;
(2)①a.使用分水器不断分离除去水,促进反应正向进行,生成酯的产率增大;
b.依据装置中反应物挥发出,反应物减小导致反应物的利用率降低分析;
c.根据分流漏斗的使用方法可知,下层液体从下口放出,上层液体从上层倒出,苯甲酸乙酯的密度小于水,据此判断;
d.实验的产率=$\frac{实际产量}{理论产量}$×100%;
e.若加入的Na2CO3溶液不足,在之后的蒸馏时烧瓶内会出现的白烟是固体小颗粒,可能是苯甲酸乙酯中混有未除净的苯甲酸.
解答 解:(1)①浓硫酸溶于水放出大量的热,乙醇中含有少量水,应将浓硫酸加入到乙醇中,防止硫酸溶解时放出大量的热导致液体飞溅,则加入药品的顺序为先在大试管中注入乙醇,再分别缓缓加入浓硫酸和乙酸,边加边振荡试管使之混合均匀,即加入顺序为乙醇、浓硫酸、乙酸,
故答案为:先加乙醇,再加浓硫酸,等冷却再加乙酸;
②乙酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动.故浓硫酸的作用为催化剂,吸水剂,
故答案为:催化剂、吸水剂;
③碳酸钠为强碱弱碱盐,碳酸根离子水解呈碱性,实验开始前在饱和碳酸钠加入酚酞,溶液会变红,随着乙酸乙酯的蒸出,发生反应:CH3COOH+CO32-=CH3COO-+HCO3-,碳酸根离子浓度减小,碱性减弱,所以红色会变浅,但是无气体产生,
故答案为:CH3COOH+CO32-=CH3COO-+HCO3-;
(2)①a.酯化反应是可逆反应,使用分水器不断分离除去水,促进酯化反应正反应方向进行,提高生成酯的产量,
故答案为:分离反应过程中生的水,促进酯化反应向正反应方向进行;
b.如果使用制取乙酸乙酯的装置,反应过程中加热,会使乙醇大量蒸馏出去,乙醇挥发混入酯中,降低反应物的利用率,实验效率大大降低,
故答案为:如果使用制取乙酸乙酯的装置,会使乙醇大量蒸馏出去,实验效率大大降低;
c.分流漏斗,下层液体从下口放出,上层液体从上层倒出,苯甲酸乙酯的密度小于水,所以有机层从下口放出,
故答案为:上口倒出;
d.12.20g苯甲酸的物质的量为:n=$\frac{m}{M}$=$\frac{12.20g}{122g/mol}$=0.1mol,理论生成的苯甲酸乙酯的质量为0.1×150g=15g,而实际生成苯甲酸乙酯的质量为:6mL×1.05g•ml-1=6.3g,所以实验的产率=$\frac{6.3g}{15g}$×100%=42%,
故答案为:42%;
e.加入Na2CO3能与未反应的苯甲酸和硫酸,可以除去未反应的苯甲酸和硫酸,白烟是固体小颗粒,因为苯甲酸在100℃会迅速升华,所以可能是苯甲酸乙酯中混有未除净的苯甲酸,
故答案为:在苯甲酸乙酯中有未除尽的苯甲酸,受热至100℃时升华.
点评 本题考查了物质制备方案的设计,为高频考点,明确制备原理为解答关键,试题涉及酯化反应原理、化学实验基本操作方法、产率的计算、化学平衡的影响因素等知识,注意掌握物质制备方案的设计及评价原则,试题充分考查了学生的分析能力及灵活应用基础知识的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| B. | 日常生活中无水乙醇常用于杀菌消毒 | |
| C. | SO2具有漂白性,能使碘的淀粉溶液由蓝色变为无色 | |
| D. | 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 预期现象 |
| 步骤一:用胶头滴管取出A试管中的溶液,用水稀释后,并分装在试管Ⅰ、Ⅱ中备用 | |
| 步骤二:检验Fe3+,往试管Ⅰ中,滴入几滴KSCN溶液 | 溶液呈现血红色 |
| 步骤三:检验Fe2+,往试管Ⅱ中,滴入少量KMnO4溶液(或先滴入几滴稀硫酸) | 紫红色变浅或消褪 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙醛在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:
乙醛在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、CaO、Al2O3均为碱性氧化物 | |
| B. | 液溴不导电,所以液溴是非电解质 | |
| C. | 12C与13C的核外电子排布方式相同,化学性质相同 | |
| D. | 只含共价键的物质一定是共价化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com