
 常温下,将除去表面氧化膜的A1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示.反应过程中有红棕色气体产生.下列说法错误的是( )
常温下,将除去表面氧化膜的A1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示.反应过程中有红棕色气体产生.下列说法错误的是( )| A. | t1时刻前,A1片的电极反应为:2A1-6e-+3H2O═A12O3+6H+ | |
| B. | t1时,因A1在浓硝酸中钝化,氧化膜阻碍了A1继续反应 | |
| C. | t1之后,负极Cu失电子,电流方向发生改变 | |
| D. | 烧杯中发生的离子反应为:2NO2+2OH-═2NO3-+H2O |
分析 t1时刻前,Al在浓硝酸中发生钝化过程,Al为负极,氧化得到氧化铝,应有水参加,根据电荷守恒可知,有氢离子生成,Cu为正极,硝酸根放电生成二氧化氮,应由氢离子参与反应,同时有水生成,随着反应进行铝表面钝化形成氧化膜阻碍反应进行,t1时,铜做负极,铜失电子产生铜离子,Al为正极,硝酸根在正极放电生成二氧化氮,据此解答.
解答 解:A.t1时刻前,负极Al被氧化得到氧化铝,电极反应为2A1-6e-+3H2O═A12O3+6H+,故A正确;
B.t1时,因A1在浓硝酸中钝化,氧化膜阻碍了A1继续反应,电流强度为0,故B正确;
C.t1之后,A1不能反应,变成Cu失电子,Cu作负极,电流方向与t1之前相反,故C正确;
D.整过过程中,正极都是硝酸根在正极放电生成二氧化氮,则烧杯中是二氧化氮与氢氧化钠反应生成硝酸钠、亚硝酸钠、水,离子方程式为2NO2+2OH-=NO2-+NO3-+H2O,故D错误;
故选D.
点评 本题考查原电池原理,关键是根据电流方向改变理解原电池中正负极转换,理解Al在浓硝酸中发生钝化,属于易错题目,侧重考查学生分析能力,难度较大.


科目:高中化学 来源: 题型:选择题
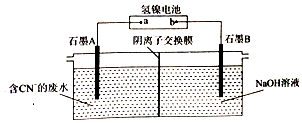
| A. | 电极a为正极 | |
| B. | 负极反应式为MH+OH--e-═H2O+MC | |
| C. | 每消耗1molC N-,理论上导线中通过3mo1e- | |
| D. | 阴极区溶液的PH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量W,υ(逆)增大 | B. | 压强不变时,反应达到平衡状态 | ||
| C. | 升高温度,υ(逆)、υ(正)都增大 | D. | 平衡后加入X,方程式中的△H增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
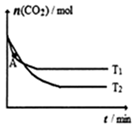 容积固定的密闭容器中,充入一定体积的CO2和H2,发生反应:CO2(g)+3H2(g)?CH3OH (g)+H2O(g).测得不同温度下CO2的物质的量随时间变化如图.下列说法正确的是( )
容积固定的密闭容器中,充入一定体积的CO2和H2,发生反应:CO2(g)+3H2(g)?CH3OH (g)+H2O(g).测得不同温度下CO2的物质的量随时间变化如图.下列说法正确的是( )| A. | 该反应为吸热反应 | |
| B. | T1、T2对应的平衡常数K1>K2 | |
| C. | T1时,图中A点的正反应速率小于逆反应速率 | |
| D. | T2时,若上述反应在压强恒定的密闭容器中进行,达平衡的时间变短 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH3$\stackrel{HCl(aq)}{→}$NH4Cl(aq) | |
| B. | AgNO3$\stackrel{NH_{3}•H_{2}O}{→}$[Ag(NH3)2]OH(aq)$→_{△}^{蔗糖}$ Ag | |
| C. | SiO2$\stackrel{HCl(aq)}{→}$SiCl4$→_{高温}^{H_{2}}$Si | |
| D. | MgCO3$\stackrel{HCl(aq)}{→}$MgCl2(aq)$\stackrel{电解}{→}$ Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液:Cu2+、Fe3+、NO3-、I- | |
| B. | 加入硫氰化钾显血红色的溶液:K+、NH4+、Cl-、NO3- | |
| C. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,c(H+)/c(OH-)=1×1012的溶液:K+、AlO2-、CO32-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2分子中只存在极性键 | B. | NH3的结构式为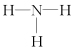 | ||
| C. | HCl的电子式为 | D. | 每个水分子内含有2个氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com