
【题目】磷酸铁锂动力电池(LiFePO4电池)是一种新型动力电池。电池的内部结构如图所示。中间是聚合物的隔膜,它把正极与负极隔开,Li+可以通过而e-不能通过。该电池的总反应式为:Li1-xFePO4+LixC6![]() C6 +LiFePO4 (注:LixC6是单质Li附在碳电极上的一种形式)。下列关于该电池的叙述错误的是
C6 +LiFePO4 (注:LixC6是单质Li附在碳电极上的一种形式)。下列关于该电池的叙述错误的是
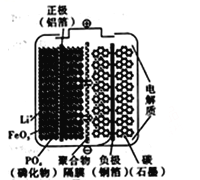
A. 放电时, LixC6在负极上失电子发生氧化反应
B. 在充电时,正极中的Li+通过聚合物隔膜向负极迁移
C. 放电时,正极反应式为Li1-xFePO4+xLi+= LiFePO4-xe-
D. 若用该电池电解精炼铜,阴极质量增重19.2kg时,则电池中通过聚合物隔膜的Li+数目为0.6NA
【答案】D
【解析】试题分析:该电池放电时,LixC6在负极上发生氧化反应,Li1-xFePO4在正极上发生还原反应。A. 由电池的总反应可知,放电时, LixC6在负极上失电子发生氧化反应,A正确;B. 在充电时,正极连接电源正极变为阳极,发生氧化反应, Li+通过聚合物隔膜向阴极(放电时是负极)迁移,B正确;C. 放电时,正极发生还原反应,电极反应式为Li1-xFePO4+xLi+= Li1-xFePO4-xe-,C正确;D. 若用该电池电解精炼铜,阴极质量增重19.2kg时,则生成铜的物质的量为300mol,电子转移600mol,所以,电池中通过聚合物隔膜的Li+数目为600NA,D不正确。本题选D。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.煤转化为水煤气的主要化学反应为:C+H2O(g) ![]() CO+H2 . C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
CO+H2 . C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
①C(s)+O2(g)=CO2(g)△H1=﹣393.5kJmol﹣1;
②H2(g)+ ![]() O2(g)=H2O(g)△H2=﹣242.0kJmol﹣1;
O2(g)=H2O(g)△H2=﹣242.0kJmol﹣1;
③CO(g)+ ![]() O2(g)=CO2(g)△H3=﹣283.0kJmol﹣1;
O2(g)=CO2(g)△H3=﹣283.0kJmol﹣1;
试回答:
(1)请你根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式: .
(2)比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和,比1molC(s)完全燃烧放出的热量(填“多”或“少”).
甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量”.乙同学根据盖斯定律作出了下列循环图
请你写出△H1、△H2、△H3、△H4之间存在的关系式 .
乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同.”请分析:甲、乙两同学的观点正确的是(填“甲”或“乙”)同学,另一同学出现错误观点的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有 K+、NH4+、Ca2+、Cl–、SO42–、CO32–中的若干种。为了确定该溶液的组成,取100mL上述溶液进行了如下实验:(所加试剂均过量,气体全部逸出)下列说法不正确的是
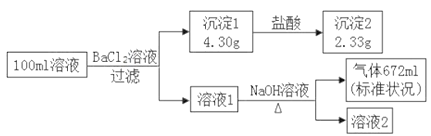
A. 原溶液中一定存在SO42–、CO32–和NH4+
B. 原溶液中一定不存在Ca2+,无法判断Cl–是否存在
C. 要确定Cl–是否存在,可取少许溶液2加入硝酸银和稀硝酸检验
D. 原溶液中 c(K+ )≥0.1 mol· Lˉ 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42﹣ .
Ⅰ某校研究性学习小组设计如图流程以回收铜和硫酸亚铁.请回答:
(1)反应①的离子方程式为 .
(2)操作①中用到的玻璃仪器是(填序号).
a.烧杯 b.漏斗 c.玻璃棒 d.酒精灯
(3)固体成份是(填名称).
(4)原料②的名称为 .
Ⅱ回收的铜可用于制备胆矾(CuSO45H2O).,可将铜和一定浓度稀硫酸混合后并在加热的情况下通入氧气,发生如下反应:2Cu+2H2SO4+O2 ![]() 2CuSO4+2H2O.制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾.
2CuSO4+2H2O.制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾.
①请分析2Cu+2H2SO4+O2 ![]() 2CuSO4+2H2O反应中,氧化剂是 , 还原剂是(填化学式).
2CuSO4+2H2O反应中,氧化剂是 , 还原剂是(填化学式).
②用双线桥标出上述反应的电子得失 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,△H1=-393.5 kJ· mol-1,△H2=-395.4kJ· mol-1,下列说法或表示式正确的是

A. C(s、石墨)== C(s、金刚石) △H= +1.9 kJ· mol-1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性强于石墨
D. 石墨的总键能比金刚石的总键能小1.9 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔和乙烯都是基本的重要有机化工原料。由它们和常见的有机物可合成一种醚类香料和制备聚乙烯醇缩丁醛。具体合成路线如图所示(部分反应条件和产物略去):
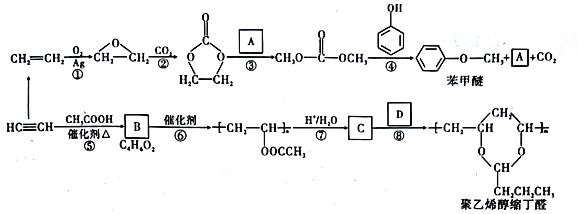
已知以下信息:
![]() 。
。
回答下列问题:
(1)A的名称是_________________,D中含有的官能团名称是________________________。
(2)B的结构简式为__________________。聚乙烯醇缩丁醛的分子式为_________________________。
(3)⑦的反应类型是__________________________。
(4)写出反应③的化学方程式:_____________________________________。
(5)M 与碳酸二甲酯(![]() )互为同系物,满足下列条件的M 的同分异构体共有______种。其中核磁共振氢谱有3组峰,峰面积之比为3 :2 :3,该同分异构体的结构简式为________________。
)互为同系物,满足下列条件的M 的同分异构体共有______种。其中核磁共振氢谱有3组峰,峰面积之比为3 :2 :3,该同分异构体的结构简式为________________。
①相对分子质量比碳酸二甲酯多14;
②酸性条件下能发生水解,且水解后的产物不含 结构;
结构;
③分子中不含醚键结构(![]() )。
)。
(6)参照上述合成路线,设计一条由2-氯丁烷和必要的无机试剂制备 的合成路线(注明必要的反应条件)。___________________
的合成路线(注明必要的反应条件)。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al-Ag2O电池是一种以NaOH溶液为电解质的水下动力电源,下列说法不正确的是
A. 负极反应式为:Al+4OH--3e-=A1O2-+2H2O
B. 负极可能会发生副反应:2Al+2OH-+2H2O=2A1O2-+3H2↑
C. 当电路中转移0 05mole-时,正极质量减少0.4g
D. 电池工作时,正极附近pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以工业制立德粉后的铅锌废渣(主要成分为ZnO和PbSO4,杂质含Si、Fe、Cu、Cd等元素)为原料,可以制活性氧化锌和黄色颜料铅铬黄,工业流程如图所示:
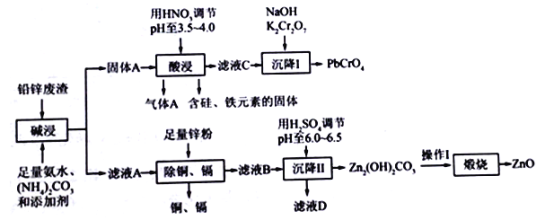
已知:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)= 7.4×10-14
(1)“碱浸”过程中PbSO4发生反应的离子方程式为_________________________,气体A 的化学式为____________________。
(2)“酸浸”过程中pH不宜过低,若pH过低,可能出现的问题是___________________________。
(3)“沉降I”过程中发生反应的离子方程式为_____________________________________。
(4)滤液D中溶质的主要成分为_____________,为制得较为纯净的ZnO,“煅烧”之前应该进行的操作I是_____________________________。
(5)以1t含锌元素10%的铅锌废渣为原料,制得活性氧化锌113.4kg,依据以上数据_______(填“能”或“不能”)计算出锌元素的回收率。若能,写出计算结果,若不能,请说明理由________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com