
【题目】室温下,CuSO4·5H2O(s)、CuSO4(s)与其水溶液之间转化的焓变关系如图:

己知CuSO4·5H2O(s)溶于水,溶液温度降低;CuSO4(s)溶于水,溶液温度升高。
下列有关说法不正确的是( )
A.△H2=△H1+△H3
B.1mol CuSO4(s)的总能量大于1mol Cu2+(aq)与1mol SO42-(aq)的总能量
C.△H2<△H1
D.从硫酸铜溶液中析出CuSO4·5H2O(s)的反应焓变△H>0
【答案】D
【解析】
CuSO45H2O(s)溶于水,溶液温度降低,则CuSO45H2O(s)=Cu2+(aq)+SO42-(aq)+5H2O(l)△H2>0,为吸热反应;CuSO4(s)溶于水,溶液温度升高,则CuSO4(s)=Cu2+(aq)+SO42-(aq)△H3<0,为放热反应;CuSO45H2O(s)![]() CuSO4(s)+5H2O(l)△H1,由盖斯定律可知△H1=△H2-△H3,以此解答该题。
CuSO4(s)+5H2O(l)△H1,由盖斯定律可知△H1=△H2-△H3,以此解答该题。
A.由盖斯定律可知△H1=△H2-△H3,故A正确;
B.图中△H3<0,可知1mol CuSO4(s)的总能量大于1mol Cu2+(aq)与1mol SO42-(aq)的总能量,故B正确;
C.△H2>0,△H3<0,△H1=△H2-△H3,则△H2<△H1,故C正确;
D.图中△H2>0,可知从硫酸铜溶液中析出CuSO45H2O(s)的反应焓变△H<0,故D错误;
故答案选D。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |

A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B. 丙容器的体积V>0.5L
C. 当温度为T1℃时,反应的平衡常数K=2.25
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量的叙述不正确的是( )
A.活化能的大小对化学反应的能量变化不产生影响
B.化学键的断裂和形成是化学反应中发生能量变化的主要原因
C.HCl(aq)和NaOH(aq)反应的中和热为57.3kJ/mol,则CH3COOH(aq)和NaOH(aq)完全反应生成1molH2O(l)时,放出的热量为57.3kJ
D.CO(g)的燃烧热是283.0kJ/mol,则反应2CO2(g)=2CO(g)+O2(g)的反应热![]() =+566.0kJ/mol
=+566.0kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香油酚经多步反应合成(见图)。有关上述两种化合物的说法不正确的是( )
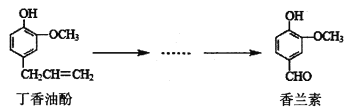
A.在丁香油酚分子中至少有12个原子共平面
B.常温下,1mol丁香油酚可与2molBr2反应
C.1moI香兰素最多能与4mol氢气发生加成反应
D.可用酸性KMnO4溶液检验丁香油酚中是否含有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酮洛芬是一种良好的抗炎镇痛药,可以通过以下方法合成:
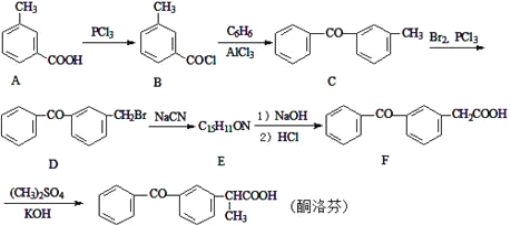
(1)化合物D中所含官能团的名称为_________________。
(2)化合物E的结构简式为___________________;由B→C的反应类型是_____________。
(3)写出C→D的反应方程式____________________________。
(4)写出同时满足下列条件的A的一种同分异构体的结构简式____________________。
I.能发生银镜反应; Ⅱ.与FeCl3发生显色反应; Ⅲ.分子中含有5种不同化学环境的氢.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏伽德罗常数.已知C2H4和C3H6的混合物的质量为ag,则该混合物( )
A.燃烧时消耗的O2一定是![]()
B.所含原子总数为![]()
C.所含碳氢键数目为![]()
D.所含共用电子对数目为(![]() )NA
)NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是一种常见的过氧化物,具有强氧化性和漂白性,通常可用作漂白剂和呼吸面具中的供氧剂。
(1)某实验小组通过下列实验探究过氧化钠与水的反应:

①用化学方程式解释使酚酞试液变红的原因: ______,依据实验现象推测红色褪去的原因是______。
②加入MnO2发生反应的化学方程式为_________。
(2)实验小组两名同学共同设计如下装置探究过氧化钠与二氧化硫的反应。通入SO2将带余烬的木条插入试管C中,木条复燃。

①甲同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是______,检验反应后B中的白色固体含有Na2SO3的方法是________。
②乙同学认为反应后的B中有Na2SO3,还会有Na2SO4。乙同学猜想的理由是_________。为检验产物中Na2SO4的存在,乙同学设计如下实验方案:

甲同学认为该实验方案的现象不能证明有Na2SO4生成,其理由为______________。
③请补充完整实验小组测定B中反应完全后固体组成的实验方案:称取样品a g加水溶解,___,烘干,称量沉淀质量为b g,然后计算各物质的含量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度、压强下,向密闭容器中投入一定量N2和H2,发生反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0。
2NH3(g) △H<0。
(1)反应开始阶段,V(正)_______(填“>”“<”或“=”)v(逆),随后v(正)逐渐______(填“增大”或“减小”,下同),v(逆)逐渐_________,反应达到平衡时,v(正)等于v(逆)。
(2)达到平衡后,若正反应速率用v(N2)表示,逆反应速率用v'(H2)表示,则v(N2)=_____v'(H2)。
(3)下列措施中能加快反应速率并提高氢气的转化率的是_____________(填字母)。
A.其他条件不变时,压缩容器体积 B.其他条件不变时,升高反应体系温度
C.使用合适的催化剂 D.保持容器体积不变,充入一定量的氮气
(4)实际生产中往往需要将温度控制在一个合适的范围,分析温度不宜过高也不宜过低的原因:_________________________________________________________。
(5)写出合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的平衡常数表达式:____________________。升高温度时K值_________(填“增大”“减小”或“不变”)。
2NH3(g)的平衡常数表达式:____________________。升高温度时K值_________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯(属于酯类,代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。测得其相对分子质量为162,分子中C、H、O原子个数比为5︰5︰1,且分子中只含有1个苯环,苯环上只有一个取代基。现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1︰2︰2︰1︰1︰3。下列说法不正确的是
A.M的分子式为C10H10O2
B.1mol的M最多能被4molH2还原
C.肉桂酸能使溴水和酸性高锰酸钾溶液褪色
D.与M含有相同官能团,且苯环上氢的化学环境只有两种的同分异构体有3种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com