
| A、标准状况下,11.2LH2O含有的分子数为0.5NA |
| B、含有NA个氦原子的氦气在标准状况下的体积约为l1.2L |
| C、25℃、l标准大气压下,64gSO2中含有的原子数为3NA |
| D、在常温常压下,11.2LCl2含有的分子数为0.5NA |
| 64g |
| 64g/mol |
| 64g |
| 64g/mol |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
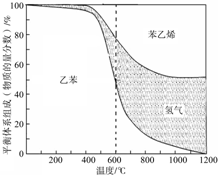 苯乙烯是重要的基础有机原料.工业中用乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)的反应方程式为:
苯乙烯是重要的基础有机原料.工业中用乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)的反应方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:
 关于如图所示①、②两个装置的评价正确的是( )
关于如图所示①、②两个装置的评价正确的是( )| 选择 | 叙 述 | 评价 |
| A | 装置名称:①电解池,②原电池 | 错误 |
| B | 硫酸浓度变化:①增大,②减小 | 错误 |
| C | 电极反应式:①阳极:4OH--4e-═2H2O+O2↑ ②正极:Zn-2e-═Zn2+ | 正确 |
| D | 离子移动方向:①H+向阴极移动 ②H+向正极移动 | 正确 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl=H2SO4>CH3COOH |
| B、HCl>H2SO4>CH3COOH |
| C、H2SO4>HCl>CH3COOH |
| D、HCl=H2SO4=CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示装置I是一种可充电电池,装置Ⅱ为电解池.离子交换膜只允
如图所示装置I是一种可充电电池,装置Ⅱ为电解池.离子交换膜只允| 充电 |
| 放电 |
| A、当有0.01mol Na+通过离子交换膜时,b电极上析出112mL的气体 |
| B、负极反应为3Br--2e-=Br3- |
| C、闭合K后,b电极附近的pH变小 |
| D、闭合K后.a电极上有氯气产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加压强 |
| B、升高温度 |
| C、增大CO 的浓度 |
| D、更换催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com