据报道双氧水接触银能剧烈反应,为消除用硝酸清洗试管内壁上的银时产生的有毒气体污染环境,体现“绿色化学”的理念,某学校活动小组利用该反应清洗试管内壁上的银,并进一步研究反应的机理.他们查阅资料(资料信息:硝酸氧化性比过氧化氢强,能氧化过氧化氢;碘化银为黄色固体;稀硝酸与银单质反应条件为加热),设计并完成了以下实验.
第一步 清洗:取10mL 10% H
2O
2溶液清洗附有银的试管.反应剧烈,并产生大量的气体(经验证为氧气),试管内壁上的银全部被清除干净,最后得澄清透明液体a.用激光照射液体a能看到丁达尔效应.
第二步 探究反应原理:取2支试管,分别取液体a约1mL,稀释至3mL得液体b.
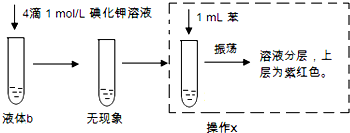
学生甲:将1支盛有液体b的试管进行如下实验
学生乙:向液体b中加入4~5滴稀硝酸酸化的2mol/LNaCl溶液,溶液中出现白色沉淀.
通过上述实验,他们认为H
2O
2氧化了银单质.请回答:
(1)液体a在分散系分类中属于
.
(2)操作x名称是
.
(3)学生甲在液体b中加入碘化钾溶液,没有看到预期的黄色的碘化银沉淀,可能的原因是
(填序号).
①液体a中的银元素大多数以银单质的形式存在
②过量的H
2O
2将I
-氧化为I
2③加入的碘化钾溶液量太少
(4)学生乙在实验中加入4~5滴稀硝酸酸化的原因是
.
(5)如果银与H
2O
2反应生成的物质对H
2O
2的分解有催化作用,通过分析可以推测,起催化作用的物质是
.



 据报道双氧水接触银能剧烈反应,为消除用硝酸清洗试管内壁上的银时产生的有毒气体污染环境,体现“绿色化学”的理念,某学校活动小组利用该反应清洗试管内壁上的银,并进一步研究反应的机理.他们查阅资料(资料信息:硝酸氧化性比过氧化氢强,能氧化过氧化氢;碘化银为黄色固体;稀硝酸与银单质反应条件为加热),设计并完成了以下实验.
据报道双氧水接触银能剧烈反应,为消除用硝酸清洗试管内壁上的银时产生的有毒气体污染环境,体现“绿色化学”的理念,某学校活动小组利用该反应清洗试管内壁上的银,并进一步研究反应的机理.他们查阅资料(资料信息:硝酸氧化性比过氧化氢强,能氧化过氧化氢;碘化银为黄色固体;稀硝酸与银单质反应条件为加热),设计并完成了以下实验.