
【题目】亚硫酸盐是一种常见的食品添加剂,用如图实验可检验某食品中亚硫酸盐含量(所 加试剂均足量). ![]()
下列说法不正确的是( )
A.亚硫酸盐作为食品添加剂,作用是防腐保鲜
B.反应①过程中通入N2的作用是将装置中空气和生成的气体全部赶出
C.测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量
D.若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响
【答案】D
【解析】解:样品中加稀硫酸生成二氧化硫,通氮气将生成的二氧化硫从溶液中全部赶出,得到气体A为氮气和二氧化硫的混合气体,通入双氧水中,二氧化硫被氧化成硫酸,再用氢氧化钠中和得中和液含有硫酸钠,A.亚硫酸盐有还原性,可以防止食品被空气中氧气氧化,起到了防腐、抗氧化作用,故A正确;
B.根据上面的分析可知,反应①中通入N2的作用是将生成的气体全部赶出,故B正确;
C.根据③中耗碱量可以计算出生成的硫酸的物质的量,利用硫元素守恒可知二氧化硫的质量,结合样品的质量可求得样品中亚硫酸盐含量,故C正确;
D.H2O2溶液替换为碘水,如果碘过量,碘与氢氧化钠反应,所以无法根据氢氧化钠的物质的量确定生成的硫酸的物质的量,故D错误;
故选D.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】化学反应常伴随着颜色变化,下列有关反应的颜色变化正确的是( )
A.溴水遇乙烯——白色B.淀粉遇单质碘——棕黄色
C.热的氧化铜遇乙醇——蓝色D.热的新制氢氧化铜遇葡萄糖——砖红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在应用中,只应用其化学性质的是
A. 将活性炭放入冰箱中除去异味B. 用铅笔芯粉末使锁的开启变的更灵活
C. 用二氧化碳灭火D. 用一氧化碳来冶炼生铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的物质,可用于制取化肥和硝酸等.已知H﹣H键、N﹣H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol.
(1)写出合成氨的热反应方程式 .
生成1molNH3需要吸收或放出kJ
(2)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示.图中t1 时引起平衡移动的条件可能是 . 其中表示平衡混合物中NH3的含量最高的一段时间是 . 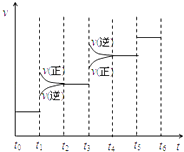
(3)温度为T℃时,将2a molH2和a molN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则该反应的平衡常数为 .
(4)已知373K时,可逆反应平衡常数为K=0.12,若某时刻时,测得 C(N2)=1mol/L,C(H2)=3mol/L,C(NH3)=2mol/L.此刻可逆反应
A.向正方向进行
B.向逆方向进行 C处于平衡状态.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向饱和澄清石灰水中加入少量CaC2,充分反应后恢复到原来的温度,所得溶液中
A.c(Ca2+)、c(OH-)均增大B.c(Ca2+)、c(OH-)均保持不变
C.c(Ca2+)、c(OH-)均减小D.c(OH-)增大、c(H+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 .
(2)烧杯间填满碎泡沫塑料的作用是 .
(3)理论上稀的强酸溶液与强碱溶液反应生成1mol水时放出57.3kJ的热量,写出表示稀盐酸和稀氢氧化钠溶液反应的中和热的热化学方程式:
(4)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大”、“偏小”或“无影响”).
(5)实验中改用60mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”),简述理由: .
(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会(填“偏大”“偏小”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下CO2、H2、CO的混合气体与氮气的密度相同,则该混合气体中CO2、H2、CO的质量之比可能为( )
A.13:8:27
B.13:9:27
C.26:16:27
D.286:8:27
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 原电池中的电极一定要由两种不同的金属组成
B. 原电池两极均发生氧化还原反应
C. 原电池中电子流出的一极是正极,发生氧化反应
D. 原电池中阳离子向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一,可由氨气和氟气反应得到:4NH3+3F2═NF3+3NH4F.在潮湿的空气中,NF3能与水蒸气发生氧化还原反应,其反应的产物有HF、NO和HNO3 . 下列说法正确的是( )
A.制取NF3的反应中,氧化剂与还原剂的物质的量之比为3:1
B.在NF3与H2O的反应中,H2O作还原剂
C.若在制取NF3的反应中有0.5 mol NH3参加反应,转移电子的物质的量为3 mol
D.NF3在空气中一旦泄漏,不易于发现
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com