
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂溶解在亚硫酰氯(SOCl2)中形成,电池的总反应式为8Li+3SOCl2=6LiCl+Li2SO3+2S,则下列叙述正确的是 ( )
A.用该电池电解CuCl2溶液产生2.24LCl2时,有0.2mol电子转移
B.金属锂作电池的负极,石墨作电池的正极,加入硫酸可提高电解质的导电性
C.电池工作(放电)过程中,SOCl2被还原为Li2SO3
D.电池工作过程中,负极消耗的锂与正极生成的硫质量之比为7:8
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
含有2~5个碳原子的直链烷烃沸点和燃烧热的数据见下表:
| 烷烃名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 沸点(℃) | -88.6 | -42.1 | -0.5 | 36.1 |
| 燃烧热(kJ·mol-1) | 1560.7 | 2219.2 | 2877.6 | 3535.6 |
*燃烧热:1摩尔物质完全燃烧,生成二氧化碳、液态水时所放出的热量
根据表中数据,下列判断错误的是( )。
A.正庚烷在常温常压下肯定不是气体
B.烷烃燃烧热和其所含碳原子数成线性关系
C.随碳原子数增加,烷烃沸点逐渐升高
D.随碳原子数增加,烷烃沸点和燃烧热都成比例增加
查看答案和解析>>
科目:高中化学 来源: 题型:
SiCl4的分子结构与CCl4类似,对其作出如下推断,其中正确的是( )
①SiCl4晶体是分子晶体 ②常温、常压下SiCl4是液体
③SiCl4的分子是由极性键形成的 ④SiCl4熔点高于CCl4
A.全部 B.只有①② C.只有②③ D.只有①
查看答案和解析>>
科目:高中化学 来源: 题型:
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- = 4OH -
B.铅蓄电池充电时,标示“+”的接线柱连电源的正极,电极反应式为:PbSO4(S) -2e - + 2H2O(l)=PbO2(S) + 4H+(aq)+ SO42-(aq)
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e- = Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e - = Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下述实验不能达到预期实验目的的是( )
| 序号 | 实验内容 | 实验目的 |
| A | 将2.5gCuSO4·5H2O溶解在97.5g水中 | 配制质量分数为1.6%的CuSO4溶液 |
| B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
10000C时,硫酸钠可与氢气发生反应:

 。请回答下列问题:
。请回答下列问题:
(1)上述反应的平衡常数表达式为: 。
(2)上述反应在三个不同条件下进行,其中H2的浓度随时间的变化如图所示。

①与曲线a比较,b和c分别仅改变一种反应条件,则曲线b改变的条件为
②该反应的△H___0(填“>”、“<”或“=”),其判断理由是 。
(3)该温度下,向2L盛有1.42g Na2SO4的密闭容器中通入H2,5min后测得
固体质量为1.10g。则该时间范围内的平均反应速率v(H2)= 。
(4)能说明该反应已达到平衡状态的是 (填字母,下同)。
a.容器内压强保持不变
b.容器内气体密度保持不变
c.c(H2)=c(H2O)d.v正(H2)=v逆(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
丙酮(C3H6O)通常是无色液体,与水混溶,密度小于1g·mL-1,沸点约为56℃。要从水与丙酮的混合物中将丙酮分离出来,你认为下列方法中最为合理的是 ( )
A.蒸馏 B.分液 C.过滤 D.蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
用18 mol·L-1 浓硫酸配制100 mL 3.0 mol·L-1 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④
⑤转移、洗涤 ⑥定容、摇匀 ⑦装瓶贴标签
完成下列问题:
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 (从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL
(2)第③步实验的操作是
。
(3)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中_______________________;
B.容量瓶用蒸馏水洗涤后残留有少量的水________________;
C.所用过的烧杯、玻璃棒未洗涤________________;
D.定容时俯视刻度线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
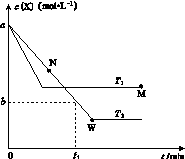
在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)= mol·L-1·min-1
mol·L-1·min-1
C.M点的正反应速率v正大于N点的逆反应速率v逆
D.M点时再加入一定量Y,平衡后X体积分数与原平衡相比增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com