
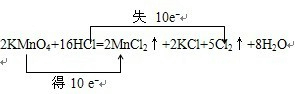
 ,故答案为:
,故答案为: ;
;

科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:福建省南安一中高一化学《氧化还原反应2》同步练习卷(带解析) 题型:填空题
高锰酸钾和浓盐酸可以发生下列反应:
2KMnO4+16HCl(浓)===5Cl2↑+2MnCl2+2KCl+8H2O
(1)该反应的氧化剂是___ ___,还原剂是___ _____。
(2)若消耗0.2 mol氧化剂,则被氧化的还原剂的物质的量是________ mol。
查看答案和解析>>
科目:高中化学 来源:福建省高一化学《氧化还原反应2》同步练习卷(解析版) 题型:填空题
高锰酸钾和浓盐酸可以发生下列反应:
2KMnO4+16HCl(浓)===5Cl2↑+2MnCl2+2KCl+8H2O
(1)该反应的氧化剂是___ ___,还原剂是___ _____。
(2)若消耗0.2 mol氧化剂,则被氧化的还原剂的物质的量是________ mol。
查看答案和解析>>
科目:高中化学 来源:2009-2010学年四川省宜宾一中高一(上)期末化学复习卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com