
A.H2O2的电离方程式可写作H2O2 H++HO2-,HO2- H++HO2-,HO2- H++O42- H++O42- |
| B.加水稀释过程中,K1(H2O2)增大,α(H2O2)增大,c(H+)增大 |
| C.加入少量浓盐酸,过氧化氢的电离平衡逆向移动,水的电离平衡逆向移动 |
| D.加入少量氯化铁溶液,溶液中产生大量气泡 |
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.等物质的量浓度的溶液中,水电离出的c(H+):HCl>CH3COOH |
| B.pH相同的溶液中:c(Na2CO3)<c(NaHCO3) |
| C.在Na2SO3溶液中:c(Na+)= 2c(SO32-)+ c(HSO3-)+ c(OH-) |
| D.0.1mol·L-1NaHS溶液中:c(Na+)= c(HS-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.多元弱酸的酸性主要由第一步电离决定,亚硫酸的酸性弱于碳酸 |
| B.多元弱酸的酸性主要由第二步电离决定,碳酸的酸性弱于亚硫酸 |
| C.多元弱酸的酸性主要由第一步电离决定,亚硫酸的酸性强于碳酸 |
| D.多元弱酸的酸性主要由第二步电离决定,碳酸的酸性强于亚硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(NH)/c(NH3·H2O)比值减小 | B.OH-个数将减少 |
| C.c(OH-)/c(NH3·H2O)比值减小 | D.NH4+浓度将减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HBr、HCl、BaSO4 |
| B.NH4Cl、CH3COOH、Na2S |
| C.NaOH、Ca(OH)2、NH3·H2O |
| D.HClO、NaF、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AlCl3溶液中再溶入AlCl3 |
| B.CH3COONa溶液加热 |
| C.氨水中加入少量NH4Cl固体 |
| D.醋酸溶液加热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
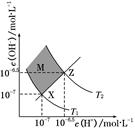
| A.两条曲线间任意点均有c(H+)×c(OH-)=KW |
| B.M区域内任意点均有c(H+)<c(OH-) |
| C.图中T1<T2 |
| D.XZ线上任意点均有pH=7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com