
分析 (1)钠与水反应生成氢氧化钠和氢气;
(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
(3)氨水为弱碱,二者反应生成氢氧化铝沉淀和氯化铵;
(4)氢氧化铝为两性氢氧化物,能够与氢氧化钠溶液反应生成偏铝酸钠和水;
(5)氢氧化钡过量,反应生成硫酸钡沉淀、偏铝酸钾.
解答 解:(1)Na与水反应生成氢氧化钠和氢气,反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(2)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子反应方程式为:2Al+2H2O+2OH-═2AlO2-+3H2↑,
故答案为:2Al+2H2O+2OH-═2AlO2-+3H2↑;
(3)氯化铝和氨水反应生成氢氧化铝和氯化铵,反应的离子反应为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(4)氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(5)假设SO42-的物质的量为2mol,则明矾溶液中含有2mol SO42-,1molAl3+,向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,需要2molBa(OH)2,即加入的Ba2+为2mol,OH-为4mol,生成2molBaSO4,1molAl3+与4molOH-反应生成1molAlO2-,反应的离子方程式为:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,
故答案为:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O.
点评 本题考查了离子方程式的书写,题目难度中等,明确发生反应实质为解答关键,注意熟练掌握离子方程式的书写原则,试题培养了学生的分析能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
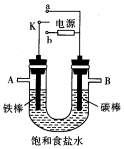 根据如图装置进行电化学的相关实验,回答下列问题.
根据如图装置进行电化学的相关实验,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3 | |
| B. | 取一定量固体,溶解,向溶液中通入的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3 | |
| C. | 取一定量固体,加热,若产生的气体能使澄清石灰水变浑浊,说明原固体中一定含有NaHCO3 | |
| D. | 取一定量固体,滴加0.l mol/L盐酸至1L时,溶液呈中性,说明固体中各物质的物质的量总和为0.05 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,逆反应速率加快,正反应速率减慢 | |
| B. | 使用催化剂比不使用催化剂化学平衡常数要大 | |
| C. | 由勒夏特列原理可知合成氨时,分离出NH3可以提高原料利用率 | |
| D. | 加压能加快反应速率,因为增加了活化分子百分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用镊子从试剂瓶中夹取钠块 | |
| B. | 用水清洗试管内壁附着的硫 | |
| C. | 采用“扇闻”的方法闻氯气的气味 | |
| D. | 用洁净的铂丝蘸取溶液进行焰色反应的实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
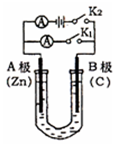 如图所示,U形管内盛有200mL的溶液,按要求回答下列问题.
如图所示,U形管内盛有200mL的溶液,按要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaOH溶液吸收尾气中的氯气:Cl2+4OH-═2ClO-+2H2O | |
| B. | SO2饱和溶液中NH4+、K+、CO32-、SO32-可大量存在 | |
| C. | 2Fe3++Fe═3Fe2+成立,说明氧化性:Fe3+>Fe2+ | |
| D. | 向NaHS溶液中加入适量硝酸发生反应:HS-+H+═H2S↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com