
下列表示对应化学反应的离子方程式正确的是
A.MnO2 与浓盐酸反应制Cl2:MnO2+4HCl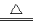 Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B.明矾溶于水产生Al(OH)3 胶体:Al3++3H2O === Al(OH)3↓+3H+
C.Na2O2 溶于水产生O2:Na2O2+H2O === 2Na++2OH-+O2↑
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3- +Ca2++OH-=== CaCO3↓+H2O
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:简答题
氮的固定有三种途径:生物固氮、自然固氮和工业固氮。根据最新“人工固氮”的研究报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105 Pa、反应时间1 h):
T/K | 303 | 313 | 323 | 353 |
NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
相应的化学方程式:2N2(g)+6H2O(l)  4NH3(g)+3O2(g)ΔH=a kJ·mol-1
4NH3(g)+3O2(g)ΔH=a kJ·mol-1
回答下列问题:
(1)此合成反应的a________0;ΔS________0,(填“>”、“<”或“=”)
(2)已知:N2(g)+3H2(g)  2NH3(g) ΔH=-92 .4 kJ·mol-1
2NH3(g) ΔH=-92 .4 kJ·mol-1
2H2(g)+O2(g) ===2H2O(l) ΔH =-571.6 kJ·mol-1
则2N2(g)+6H2O(l)===4NH3(g)+3O2 (g) ΔH=________kJ·mol-1
(3)从323 K到353 K,氨气的生成量减少的可能原因_________________;
(4)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g) ΔH=-92 .4 kJ·mol-1 ,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答:
2NH3(g) ΔH=-92 .4 kJ·mol-1 ,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答:

①在上述三种温度中,曲线X对应的温度是________。
②a、b、c三点H2的转化率最小的是________点、转化率最大的是________点。
③在容积为1.0 L的密闭容器中充入0.30 mol N2(g)和0.80 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。该条件下反应2NH3(g)  N2(g)+3H2(g)的平衡常数为________ 。
N2(g)+3H2(g)的平衡常数为________ 。
查看答案和解析>>
科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:选择题
熔融盐燃料电池具有高的发电效率,因而受到重视。用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池。已知该电池总反应为:2CO+O2=2CO2。则下列说法中正确的是( )
A.通CO的一极是电池的正极
B.该电池工作过程中需不断补充CO和O2,CO2可循环利用
C.负极反应式为:O2+2CO2+4e-==2CO32-
D.正极反应式为:2CO+2CO32-—4e-==4CO2
查看答案和解析>>
科目:高中化学 来源:2014江苏常熟市高二化学期末模拟4(必修2、选修4、结构)试卷(解析版) 题型:填空题
(16分)锰是冶炼工业中常用的添加剂。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是 。
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是 ,加氨水调节溶液的pH为5.0-6.0,以除去Fe3+。
(3)步骤Ⅲ中,滤渣2的主要成分是 。
(4)步骤Ⅳ中,在 (填“阴”或“阳”)极析出Mn,电极反应方程式为 。
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。进行二级沉降的目的是 。
查看答案和解析>>
科目:高中化学 来源:2014江苏常熟市高二化学期末模拟4(必修2、选修4、结构)试卷(解析版) 题型:选择题
设nA为阿伏加德罗常数的数值,下列说法正确的是
A.1L 0.1 mol·L-1NH4Cl溶液中含有0.1nA个NH4+
B.常温常压下,18g H2O含有10nA个电子
C.1 mol Cu与足量浓硫酸反应产生2nA个SO2分子
D.常温常压下,11.2L的CO含有nA个原子
查看答案和解析>>
科目:高中化学 来源:2014江苏常熟市高二化学期末模拟4(必修2、选修4、结构)试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A.8 g甲烷含有的共价键数约为NA
B.常温常压下,22.4 L二氧化碳原子总数为3NA
C.1 mol Fe与稀HNO3反应,一定转移3 NA个电子
D.1mol单质硅含有2molSi-Si键
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版4.3铜及其化合物 金属材料与复合材料练习卷(解析版) 题型:填空题
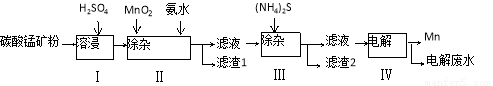
某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于 上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
实验所用仪器:
a.蒸发皿
b.石棉网
c.泥三角
d.表面皿
e.坩埚钳
f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是 。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是 、 。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行 次。
(6)若测定结果x值偏高,可能的原因是 (填字母编号)。
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版4.1硅 无机非金属材料练习卷(解析版) 题型:选择题
下列关于SiO2和CO2的叙述中不正确的是( )。
A.都是共价化合物
B.SiO2可用于制光导纤维,干冰可用于人工降雨
C.都能溶于水且与水反应生成相应的酸
D.都是酸性氧化物,都能与强碱溶液反应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版3.1碳的多样性练习卷(解析版) 题型:实验题
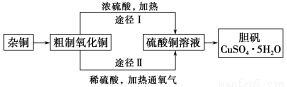
CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
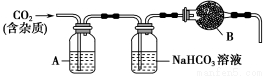
完成下列填空:
(1)用浓盐酸配制1∶1(体积比)的稀盐酸(约6 mol·L-1),应选用的仪器是 。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
(2)上述装置中,A是 ,NaHCO3溶液可以吸收 。
(3)上述装置中,B物质是 。用这个实验得到的气体测定CO2的相对分子质量,如果B物质失效,测定结果 (填“偏高”、“偏低”或“不受影响”)。
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:
剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重
为了将石蜡和碳酸钙溶出,应选用的试剂是 。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d.正己烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出 ,后溶出 。
(6)上述测定实验中,连续 ,说明样品已经恒重。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com