
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013届年天津市等三校高二上学期期末联考化学试卷 题型:选择题
下列说法中正确的是
A.在Na3PO4溶液中,c(Na+) 是c(PO43-)的3倍
B.pH=3的盐酸中,其c(H+)是pH=1的盐酸的3倍
C.0.1mol/L KOH溶液和0.1mol/L氨水中,其c(OH-)相等
D.在25°C时,无论是酸性、碱性还是中性溶液中,其c(H+)和c(OH-)的乘积都等于1
查看答案和解析>>
科目:高中化学 来源:2012届广东省高二上学期期末考试化学试卷卷 题型:填空题
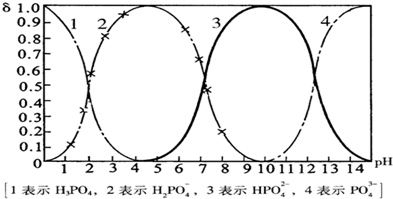
(14分)磷酸(H3PO4)在水中可分三步电离,能够以H3PO4、H2PO- 4、HPO2- 4、PO3- 4等四种粒子形式存在,当溶液的pH发生变化时,其中任一粒子的物质的量占四种粒子总物质的量的分数δ(分布分数)也可能发生变化。图1是某浓度H3PO4溶液中各种粒子的物质的量分数δ随pH的变化曲线。用NaOH标准溶液滴定该H3PO4溶液,绘得滴定曲线如图2。
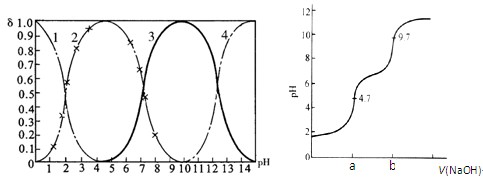
图1 H3PO4粒子分部分数与pH关系 图2 H3PO4滴定曲线(部分)
(注:图中曲线1表示H3PO4、曲线2表示H2PO- 4、曲线3表示HPO2- 4、曲线4表示PO3- 4)
(1)H3PO4第一步电离的电离常数K1的表达式为_______,K1的数值最接近(填字母)______。
A.10-2.1 B.10-4.7 C.10-7 D.10-9.7
(2)用NaOH滴定H3PO4,写出反应从a点到b点的离子方程式____________________,当滴定至pH=7时,溶液主要存在的阴离子(OH-除外)有_______________。
(3)在Na3PO4溶液中,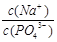 ____3(填“>”、“<”、“=”),原因是__________________(用离子方程式表示)。
____3(填“>”、“<”、“=”),原因是__________________(用离子方程式表示)。
(4)磷酸钙、磷酸一氢钙和磷酸二氢钙是三种重要的磷酸盐,在食品、化肥等方面应用广泛。其20℃时溶解度数据如下表:
|
名称 |
化学式 |
20℃时溶解度(g) |
|
磷酸钙 |
Ca3(PO4)2 |
2×10-3 |
|
磷酸一氢钙 |
CaHPO4 |
4.3×10-3 |
|
磷酸二氢钙 |
Ca(H2PO4)2 |
1.8 |
磷酸钙在水中溶解度很小,但易溶于稀盐酸。结合平衡移动原理分析其原因
_________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com