
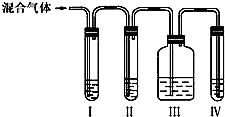


科目:高中化学 来源:不详 题型:实验题


| 管 号 | 0 | 1 | 2 | 3 | 4 | 5 |
| 标准液(ml) | 0 | 0.20 | 0.40 | 0.60 | 0.80 | 1.00 |
| 吸收液(ml) | 10.00 | 9.80 | 9.60 | 9.40 | 9.20 | 9.00 |
| 二氧化硫含量(μg) | 0 | 5.00 | 10.00 | 15.00 | 20.00 | 25.00 |
| 管 号 | 0 | 1 | 2 | 3 | 4 | 5 |
| 吸光度 | 0 | 0.20 | 0.40 | 0.60 | 0.80 | 1.00 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定没有Na2CO3和Ba(NO3)2 |
| B.一定有Na2CO3而没有Ba(NO3)2 |
| C.没有Ba(NO3)2但有KNO3,可能还有Na2CO3 |
| D.没有Na2CO3但有Ba(NO3)2和KNO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学模型有助于解释一些化学现象 |
| B.质量守恒定律是大量实验事实的总结 |
| C.化学家提出的假设都能被实验证实 |
| D.化学基本原理的应用是有一定条件的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.配制一定物质的量浓度的溶液时,若加水超过容量瓶的刻度线,用胶头滴管将多余液体吸出即可 |
| B.用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定不含有K+ |
| C.用CCl4萃取碘水后分液时,先打开分液漏斗活塞,放出下层液体,再关闭活塞,从漏斗口倒出上层液体 |
| D.检验某溶液中是否含有Fe3+时,可先加入适量的氯水,再滴加硫氰化钾溶液,若溶液变为红色,则说明溶液中一定含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.将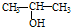 与NaOH的醇溶液共热制备CH3-CH═CH2 与NaOH的醇溶液共热制备CH3-CH═CH2 |
B.乙酰水杨酸 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备 |
| C.用蒸馏法分离苯和溴苯的混合物 |
| D.向卤代烃水解后的溶液中直接加入硝酸银溶液,可以确定卤代烃中的卤元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com