
在两个恒容的密闭容器中进行下列两个可逆反应
(甲)2NO2(g)2NO(g)+O2(g)
(乙)H2(g)+I2(g)2HI(g)
现有下列状态:
①反应物的消耗速率与生成物的生成速率之比等于系数之比
②反应物的消耗速率与生成物的消耗速率之比等于系数之比
③速率之比等于系数之比的状态
④浓度之比等于系数之比的状态
⑤百分含量之比等于系数之比的状态
⑥混合气体的颜色不再改变的状态
⑦混合气体的密度不再改变的状态
⑧混合气体的平均相对分子质量不再改变的状态
⑨体系温度不再改变的状态
⑩压强不再改变的状态
⑪反应物的浓度不再改变的状态
⑫反应物或生成物的百分含量不再改变的状态
其中能表明(甲)达到化学平衡状态的是__________;
能表明(乙)达到化学平衡状态的是__________;
能表明(甲)、(乙)都达到化学平衡状态的是__________。
科目:高中化学 来源: 题型:
标准状况下,将3.36 L CO2气体通入200 mL 1.00 mol·L-1 NaOH溶液中,充分反应后溶液中c(CO )与c(HCO
)与c(HCO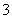 )的比值为(不考虑CO
)的比值为(不考虑CO 、HCO
、HCO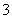 的水解)( )
的水解)( )
A.1∶1 B.1∶2
C.2∶1 D.1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
从海带中提取碘单质,成熟的工艺流程如下,下列关于海水制碘的说法,不正确的是( )
干海带 海带灰
海带灰 悬浊液
悬浊液 滤液
滤液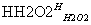 碘水
碘水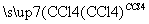 I2的CCl4溶液
I2的CCl4溶液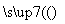 I2
I2
A.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌
B.含I-的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应
C.在碘水中加入几滴淀粉溶液,溶液变蓝色
D.碘水加入CCl4得到I2的CCl4溶液,该操作为“萃取”
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。
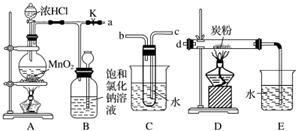
(1)要将C装置接入B和D之间,正确的接法是a→____→________→d。
(2)实验开始先点燃A处的酒精灯,打开活塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为___________________________________________________。
为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是________________________________________________________________________
________________________________________________________________________。
(3)D处反应完毕后,关闭弹簧夹K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是_________________________________________________________,
B的作用是______________________________________________________。
(4)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由并在方框中画出改进后的装置图。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:(NH4)2CO3(s)===NH4HCO3(s)+NH3(g) ΔH=74.9 kJ·mol-1。下列说法中正确的是( )
A.该反应中熵变小于0,焓变大于0
B.该反应是吸热反应,因此一定不能自发进行
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行
D.判断反应能否自发进行需要根据ΔH与ΔS综合考虑
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。

回答下列问题:
(1)反应的ΔH______0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60 s时段,反应速率v(N2O4)为__________________ mol·L-1·s-1;反应的平衡常数K1为________________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是
________________________________________________________________________
________________________________________________________________________。
②列式计算温度T时反应的平衡常数K2________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将2 mol X和2 mol Y充入2 L密闭容器中发生反应:X(g)+3Y(g)2Z(g)+aQ(g)。2 min时达到平衡,生成0.8 mol Z,测得Q的浓度为0.4 mol·L-1,下列叙述错误的是( )
A.a的值为2
B.平衡时X的浓度为0.8 mol·L-1
C.Y的转化率为60%
D.反应速率v(Y)=0.2 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的两种物质:①CCl4和CF4 ②Cl2和F2
③O2和N2 ④CO和N2 ⑤正戊烷与异戊烷,它们各自的分子间的范德华力前者大于后者的是( )
A.只有①② B.只有③④⑤
C.只有②③④ D.①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com