
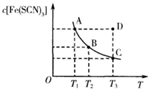
 已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )
已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )| A、A点与B点相比,A点的c( Fe3+)大 |
| B、反应处于D点时,一定有v正<v逆 |
| C、加入KCl固体可以使溶液由D点变到C点 |
| D、若T1、T2温度下的平衡常数分别为K1、K2,则K1<K2 |


科目:高中化学 来源: 题型:
| A、用锌粉代替锌粒 |
| B、改用3mol/L硫酸溶液 |
| C、改用热的2mol/L硫酸溶液 |
| D、向该硫酸溶液中加入等体积的水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在电解铝工业中添加冰晶石 |
| B、大力发展火电,缓解用电紧张 |
| C、开发太阳能、风能、氢能等清洁能源 |
| D、研制出性能优良的催化剂,降低反应所需温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
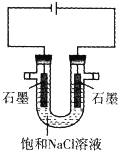
| A、滴加适量盐酸,可以使电解质溶液复原 |
| B、在U形管两端分别滴加酚酞试液,右端变红 |
| C、可用中和滴定的方法测定生成的氢氧化钠溶液的物质的量浓度 |
| D、若得到22.4 LH2(标准状况下),理论上需要转移NA个电子(NA为阿伏加德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用热的纯碱溶液清除灶具上的油污 |
| B、用硫酸清洗锅炉中的水垢 |
| C、用明矾[KAl(SO4)2.12H2O]作净水剂,除去水中悬浮的杂质 |
| D、用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 表示的粒子不会对水的电离平衡产生影响 表示的粒子不会对水的电离平衡产生影响 |
B、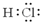 表示的物质加入水中,促进水的电离,c(H+)增大 表示的物质加入水中,促进水的电离,c(H+)增大 |
C、25℃时,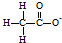 表示的微粒加入水中,促进水的电离,Kw不变 表示的微粒加入水中,促进水的电离,Kw不变 |
| D、水的电离程度只与温度有关,温度越高,电离程度越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用简易量热计能粗略测量稀盐酸和烧碱稀溶液中和反应的反应热 |
| B、pH<7的溶液不可能呈中性 |
| C、所有化学反应的反应热均可通过实验直接测定 |
| D、铅酸蓄电池充电和放电时的所发生的反应互为可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
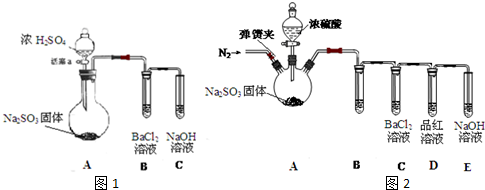
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com