
| ||
| 高温 |
| ||
| 高温 |


科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 用下面三种方法均可制得Fe(OH)2白色沉淀.
用下面三种方法均可制得Fe(OH)2白色沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | x值 | y=f(x) |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
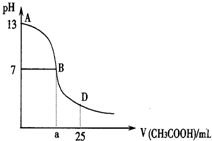 如图为向25mL 0.1mol?L-1NaOH溶液中逐滴滴加0.2mol?L-1CH3COOH溶液过程中溶液pH的变化曲线.请回答:
如图为向25mL 0.1mol?L-1NaOH溶液中逐滴滴加0.2mol?L-1CH3COOH溶液过程中溶液pH的变化曲线.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、准确称取0.4000g NaOH固体可配成100mL 0.1000mol?L-1的NaOH标准溶液 |
| B、已知Ksp[Fe(OH)3]=4.0×10-38,则Fe3++3H2O?Fe(OH)3+3H+的平衡常数K=2.5×10-5 |
| C、100mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 |
| D、对于反应2SO2(g)+O2(g)?2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A、反应在前5 s的平均速率v(A)=0.17mol?L-1?s-1 |
| B、保持其他条件不变,升高温度,平衡时c(A)=0.41mol?L-1,则反应的△H>0 |
| C、相同温度下,起始时向容器中充入0.20molA、0.20molB和1.0molC,反应达到平衡前v(正)>v(逆) |
| D、相同温度下,起始时向容器中充入2.0 molC达到平衡时,C的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、脱氧过程是吸热反应,可降低温度,延长糕点保质期 |
| B、脱氧过程中铁作原电池负极,电极反应为:Fe-3e-=Fe3+ |
| C、脱氧过程中碳作原电池正极,电极反应为:2H2O+O2+4e-=4OH - |
| D、含有1.12 g铁粉的脱氧剂,理论上最多能吸收氧气224 mL(标准状况) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com