
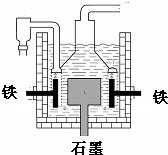
 早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )| A. | 电解熔融氢氧化钠制钠,阳极发生电极反应为:Na++e-=Na | |
| B. | 盖•吕萨克法制钠原理是利用铁的还原性比钠强 | |
| C. | 若戴维法与盖•吕萨克法制得等量的钠,则两反应中转移的电子总数比为2:1 | |
| D. | 目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极 |
分析 A.阳极氢氧根离子放电生成氧气和水;
B.1100℃时生成Na蒸气,有利于反应正向移动;
C.戴维法生成4molNa转移4mol电子,但盖•吕萨克法生成4molNa转移8mol电子;
D.石墨极为阳极,氯离子放电,在阴极钠离子放电.
解答 解:A.由4NaOH(熔)$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑+2H2O可知,阳极氢氧根离子放电生成氧气和水,电极反应为4OH--4e-=2H2O+O2↑,故A错误;
B.1100℃时生成Na蒸气,有利于反应正向移动,但Na的还原性大于Fe,故B错误;
C.由4NaOH(熔)$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑+2H2O、3Fe+4NaOH$\frac{\underline{\;通电\;}}{\;}$Fe3O4+2H2↑十4Na↑可知,戴维法生成4molNa转移4mol电子,但盖•吕萨克法生成4molNa转移8mol电子,则转移电子总数为1:2,故C错误;
D.电解熔融氯化钠法制钠时,石墨极为阳极,氯离子放电,在阴极钠离子放电,发生2NaCl$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑,如铁为阳极,则铁被氧化,故D正确;
故选D.
点评 本题考查金属的冶炼及电解原理,为高频考点,侧重于学生的分析能力的考查,明确元素的化合价变化及发生的电极反应即可解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | H2O2+SO2═H2SO4 | B. | I2+2Fe2+═2I+2Fe3+ | ||
| C. | 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | D. | SO2+2H2O+I2═H2SO4+2HI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| B. | 42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3NA | |
| C. | 标准状况下,11.2L苯中含有的碳碳双键数为1.5NA | |
| D. | 5.6g铁与0.1mol氯气在点燃条件下充分反应,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 360 | 440 | 520 |
| K | 0.036 | 0.010 | 0.0038 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
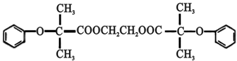 )可由下列路线合成:
)可由下列路线合成: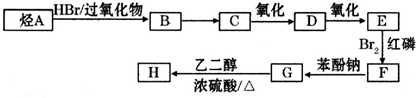
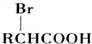
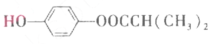 .
.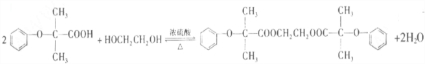 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开盛装NO的集气瓶;冷却NO2气体 | |
| B. | 用冰水混合物冷却SO3气体;加热氯化铵晶体 | |
| C. | 木炭吸附NO2气体;将氯气通入品红溶液中 | |
| D. | 向酚酞溶液中加入Na2O2;向FeCl3溶液中滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
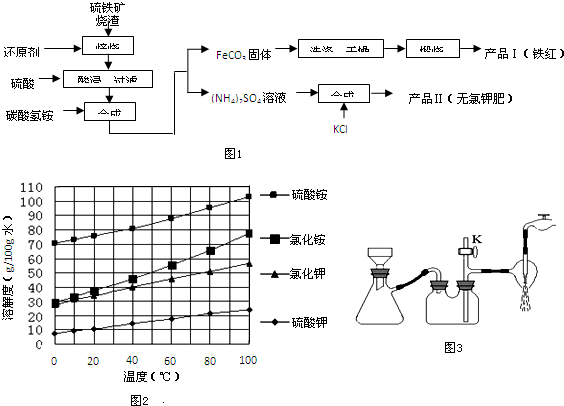
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1 mol CaC2、KHSO4、KO2(超氧化钾)三种离子化合物中,所含阴、阳离子的总数均为3NA | |
| B. | 0.1 mol C2H2OH中所含C-H键的数目为0.6NA | |
| C. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| D. | 78gNa2O2与足量水反应转移的电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com