
分析 (1)工业生产硫酸的原理:铁矿石→二氧化硫→三氧化硫→硫酸,二氧化硫的催化氧化是制备硫酸的重要步骤;
(2)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3)计算常压下的二氧化硫转化率分析判断;
②计算对应反应的焓变,依据热化学方程式书写方法写出.
解答 解:(1)二氧化硫的催化氧化是制备硫酸的重要步骤;
故答案为:硫酸(或者H2SO4);
(2)a、每生成1mol SO2的同时生成0.5mol O2,只说明逆反应速率,反应不一定达到平衡状态,故a错误;
b、容器是恒容的,无论反应是否达到平衡状态,混合物的质量始终不变,容器的体积不变,导致密度始终不变,所以不是达到平衡状态的标志,故b错误;
c、当体系达平衡状态时,SO2、O2、SO3的物质的量之比可能为2:1:2,也可能不是,与各物质的初始浓度及转化率有关,故c正确;
d、该反应是一个反应前后气体体积改变的化学反应,当反应达到平衡状态时,各物质的量不变,导致容器中压强不随时间的变化而改变,故d正确;
故选:d;
(3)①在400℃时,常压下,容积为1.0L的密闭容器中充入1.00mol SO2(g)和0.96mol O2(g),充分反应后,测得还有0.04mol SO2剩余,并放出190.08KJ的热量,反应过程中二氧化硫的转化率=$\frac{1.00mol-0.04mol}{1.00mol}$×100%=96%,在常压下,此反应的转化率已经达到96%,没有必要再增大压强了;
故答案为:在常压下,此反应的转化率已经达到96%,没有必要再增大压强了;
②依据题意可知反应0.96mol放热190.08KJ,2mol二氧化硫反应放热396KJ,热化学方程式2SO2(g)十O2(g)?2SO3(g)△H=-396KJ/mol;
故答案为:-396KJ/mol.
点评 本题考查了化学平衡影响因素分析,平衡常数计算应用,平衡状态的判断知识,掌握基础是关键,题目难度中等.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. | 生成了氢氧化铁沉淀 | |
| B. | 体系中存在着氢氧化铁的沉淀溶解平衡 | |
| C. | 溶液中不再存在Fe3+ | |
| D. | 加入少量盐酸,则溶液中Fe3+浓度会上升 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =2NaOH+H2↑.
=2NaOH+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳纤维增强复合材料可用于人体组织中韧带的制作 | |
| B. | 氮化硅陶瓷是新型无机非金属材料 | |
| C. | 银、铜、铁都是有色金属材料 | |
| D. | 碳化硅陶瓷具有压电效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
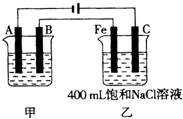 (Ⅰ)采用系统命名法:写出下列各烃的名称
(Ⅰ)采用系统命名法:写出下列各烃的名称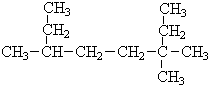 ,3,3,6-三甲基辛烷
,3,3,6-三甲基辛烷查看答案和解析>>
科目:高中化学 来源: 题型:解答题
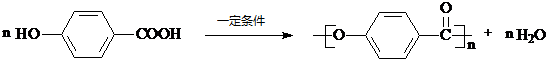
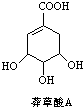 为原料的有机合成路线:
为原料的有机合成路线:
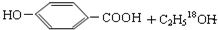 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$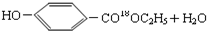 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加热到100℃,pH=6:c(H+)>c(OH-) | |
| B. | 室温下,pH=7的醋酸和醋酸钠的混合溶液中:c(CH3COO-)>c(Na+) | |
| C. | 0.1mol•L-1 的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) | |
| D. | 同浓度的三种溶液:①CH3COONH4②NH4Cl③NH3•H2O中,c(NH4+)由大到小的顺序是②③① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com