
【题目】氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
(1)当反应达到平衡时,N2和H2的浓度比是____;N2和H2的转化率比是____.反应放出的热量___(填“大于”“小于”或“等于”)184.8 kJ。
(2)降低平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____,密度____.平衡常数K_________(填“增大”“减小”或“不变”).
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_____(填“正向”“逆向”或“不”)移动.
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将_____(填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度_____(填“大于”“小于”或“等于”)原来的2倍。
【答案】 1:3 1:1 小于 变大 不变 略 逆向 略 略
【解析】(1)、加入的氮气和氢气的物质的量之比等于其化学计量数之比,无论反应到什么程度,用氮气和氢气表示的速率之比都等于化学计量数之比,所以氮气和氢气的浓度之比永始终是1:3,转化率之比1:1,故答案为:1:3;1:1。
(2)、该反应是放热反应,所以降温,平衡正向移动,气体物质的量减小,但根据质量守恒定律,质量不变,气体的平均相对分子质量=气体质量总和除以气体物质的量总和,所以,混合气体的平均相对分子质量增大;因容器体积没变,气体质量不变,所以密度不变;因K只与温度有关,降低温度,平衡正向移动,则生成物浓度增加、反应物浓度减小,根据平衡常数的定义可知,K增大;
故答案为:增大;不变;增大。
(3)、充入氩气并保持压强不变,体积变大,相关气体的分压变小,平衡向体积增大的逆向移动,故答案为:逆向;
(4)、升温,平衡向吸热的逆向移动,使体系温度降低,故答案为:向左移动;小于。


科目:高中化学 来源: 题型:
【题目】如表为元素周期表前四周期的一部分,下列有关R,W,X,Y,Z五种元素的叙述中,正确的是( ) 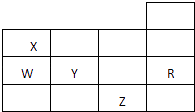
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y,Z的阴离子电子层结构都与R原子的相同
C.Y的氢化物的沸点比H2O的沸点高
D.Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是( )

A. x的位置是第2周期、第ⅠA 族
B. 离子半径的大小顺序:e+>f 3+>g2->h-
C. 由x、z、d三种元素形成的化合物可能含有离子键
D. 简单气态氢化物的稳定性大小顺序: d>g>h
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 H2 和钠反应制备氢化钠的装置如右图所示(Zn 粒中含有少量 ZnS 杂质),下列说法不正确的是

A. ①、 ②中依次盛有浓 NaOH 溶液、 浓 H2SO4
B. 管式炉加热前, 用试管收集③处气体并点燃, 通过声音判断气体纯度
C. 结束反应时, 先停止管式炉加热, 再关闭活塞 K
D. 取出瓷舟内的固体, 投入适量水中, 若有气体产生, 即可证明制得了氢化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的性质比较,不正确的是( )
A. 稳定性:NH3<PH3<SiH4 B. 酸性:HClO4>H2SO4>H3PO4
C. 碱性:KOH>NaOH>Mg(OH)2 D. 还原性:F-<Cl-<Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米技术”广泛的应用于催化及军事科学中,“纳米技术”是指粒子直径在几纳米到几十纳米的材料。如将“纳米材料”分散到液体分散剂中,所得的混合物具有的性质是( )
A.能全部通过半透膜B.能发生丁达尔现象C.一定能导电D.一定为悬浊液或乳浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“暖宝宝”的主要原料有铁粉、活性炭、水、食盐等,其中活性炭是原电池的电极之一,食盐的作用是溶于水形成电解质溶液.下列有关“暖宝宝”的说法错误的是
A.“暖宝宝”使用前要密封保存,使之与空气隔绝
B.“暖宝宝”放出的热量是铁发生氧化反应时产生的
C.活性炭作用是作原电池正极,加速铁粉的氧化
D.活性炭最终将转化为二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种天然黄铜矿主要成分为CuFeS2 (含SiO2),为了测定该黄铜矿的纯度,某同学设计了如图1实验:

称取研细的黄铜矿样品1.150g煅烧,生成Cu、Fe2O3 、FeO和SO2气体,实验后取d中溶液的1/5置于锥形瓶中,用0.01mo1/L标准碘溶液进行滴定,初读数为0.10mL,末读数如图2所示.完成下列填空:
(1)装置c的作用是____________________________。
(2)上述反应结束后,仍需通一段时间的空气,其目的是_____________________。
(3)滴定时,标准碘溶液所耗体积为_____mL;用化学方程式表示滴定的原理:________________________________________。
(4)计算该黄铜矿的纯度___________________。
(5)工业上利用黄铜矿冶炼铜产生的炉渣(含Fe2O3 、FeO、SiO2、Al2O3)可制备Fe2O3.
选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液
所选试剂为_________;证明炉渣中含有FeO的实验现象为:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com