
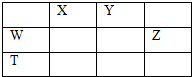
| A、X、Y、Z三种元素最低价氢化物的沸点依次升高 |
| B、由X、Y和氢三种元素形成的化合物中只有共价键 |
| C、物质WY2,W3X4,WZ4均有熔点高,硬度大的特性 |
| D、T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
| 熔点/℃ | 沸点/℃ | |
| 1-丁醇 | -89.53 | 117.25 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁 醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.5 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
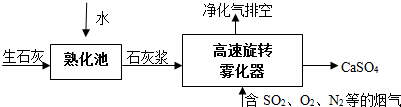
查看答案和解析>>
科目:高中化学 来源: 题型:
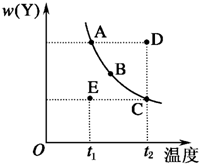 对于2X(g)?Y(g)的反应体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态).
对于2X(g)?Y(g)的反应体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态).查看答案和解析>>
科目:高中化学 来源: 题型:
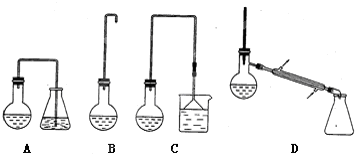
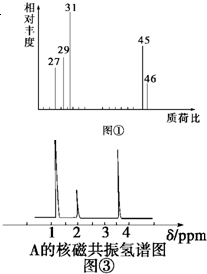 为测定某有机化合物A的结构,进行如下实验:
为测定某有机化合物A的结构,进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
A、溶液中
| ||
| B、溶液中c(H+)增大 | ||
| C、溶液的导电能力减小 | ||
| D、CH3COOH的电离程度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
| B、CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大 |
| C、Ca(HCO3)2溶液与过量NaOH溶液反应可制得Ca(OH)2 |
| D、25℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、城市采用分质供水,收集雨水进行综合利用 |
| B、推广煤的气化、液化技术,提供清洁高效燃料 |
| C、大力发展汽车产业,鼓励市民购买家用汽车 |
| D、开发利用太阳能、风能、氢能、核能等能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol FeI2与足量氯气反应时转移的电子数为2NA |
| B、2L 0.5mol?L-1硫酸钾溶液中阴离子所带电荷数为NA |
| C、1mol Na2O2固体中含离子总数为4NA |
| D、丙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com