
| A. | v(NH3)=0.010mol/(L•s) | B. | v(O2)=0.0010mol/(L•s) | ||
| C. | v(NO)=0.0010mol/(L•s) | D. | v(H2O)=0.045mol/(L•s) |
分析 在10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则(H2O)=$\frac{\frac{0.45mol}{10L}}{30s}$=0.0015mol/(L•s),结合反应速率之比等于化学计量数之比计算.
解答 解:在10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则(H2O)=$\frac{\frac{0.45mol}{10L}}{30s}$=0.0015mol/(L•s),
由反应速率之比等于化学计量数之比可知,v(NH3)=v(NO)=0.0015mol/(L•s)×$\frac{4}{6}$=0.0010mol/(L•s);
v(O2)=0.0015mol/(L•s)×$\frac{5}{6}$=0.00125mol/(L•s),
故选C.
点评 本题考查化学反应速率的计算,为高频考点,把握速率的计算公式、反应速率与化学计量数的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
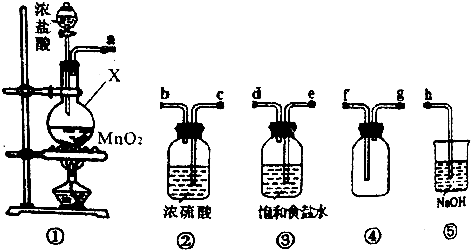
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A}$(A-Z+2m)mol | B. | $\frac{a}{A}$(A+2m)mol | C. | $\frac{a}{A+m}$(A-Z+3m)mol | D. | $\frac{a}{A+3m}$ (A-Z+2m)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | |
| R | |||
| W | |||
| J |
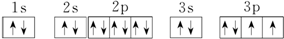 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
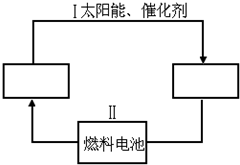 能源可化分为一级能源和二级能源.自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源.氢气是一种高效而没有污染的二级能源,而如何快速制取出大量的氢气则成为发展氢能源的主要问题.
能源可化分为一级能源和二级能源.自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源.氢气是一种高效而没有污染的二级能源,而如何快速制取出大量的氢气则成为发展氢能源的主要问题. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com