某矿石可能是由FeCO
3、SiO
2、Al
2O
3中的一种或几种组成,某研究性学习小组欲分析其成分,实验记录如图所示.
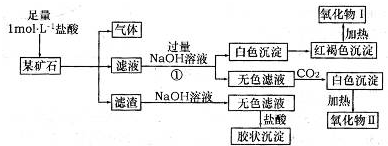
(1)该矿石中含有
FeCO3、SiO2、Al2O3
FeCO3、SiO2、Al2O3
(填化学式),请写出实验过程①中反应的离子方程式
H++OH-=H2O、Fe2++2OH-=Fe(OH)2↓、Al3++4OH-=AlO2-+2H2O
H++OH-=H2O、Fe2++2OH-=Fe(OH)2↓、Al3++4OH-=AlO2-+2H2O
.
(2)将氧化物Ⅱ在熔融状态下电解,可以得到某金属单质.当阳极上收集到气体33.6L(已折算成标准状况)时,阴极上得到该金属
54
54
g.
(3)试写出该金属与氧化物I反应的化学方程式
;将该反应的产物加入到足量烧碱溶液中,请写出发生反应的离子方程式
Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
.
(4)经进一步分析该矿石中还含有微量的SrCO
3(上述方案检测不出).锶(Sr)为第五周期ⅡA族元素.下列叙述正确的是
②
②
(填序号).
①氯化锶(SrCl
2)溶液显酸性
②SrSO
4难溶于水
③工业上可以用电解SrCl
2的水溶液制取金属锶(Sr)
④高纯六水氯化锶晶体(SrCl
2?6H
2O)必须在HCl氛围中加热才能得到SrCl
2.

