
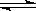 I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
A.反应 I2(aq)+I-(aq)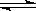 I3-(aq)的ΔH<0 I3-(aq)的ΔH<0 |
B.若温度为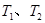 ,反应的平衡常数分别为K1、K2,则K1>K2 ,反应的平衡常数分别为K1、K2,则K1>K2 |
C.若反应进行到状态D时,一定有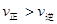 |
| D.状态A与状态B相比,状态A的c(I2)大 |
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源:不详 题型:单选题
 2 CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T),反应物配比(R=n(C2H5OCOOC2H5):n(CH3OCOOCH3))的关系如下图所示.三种反应物配比分别为1:1,2:1,3:1.下列说法不正确的是( )
2 CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T),反应物配比(R=n(C2H5OCOOC2H5):n(CH3OCOOCH3))的关系如下图所示.三种反应物配比分别为1:1,2:1,3:1.下列说法不正确的是( )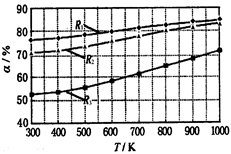
| A.该反应△H > 0 |
| B.R1对应的反应物配比为3:1 |
| C.650℃,反应物配比为1:1时,平衡常数K = 6 |
| D.该反应为取代反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g) △H = –197kJ/mol达平衡后,各容器内放出热量Q1、Q2、Q3和Q4的大小关系正确的是
2SO3(g) △H = –197kJ/mol达平衡后,各容器内放出热量Q1、Q2、Q3和Q4的大小关系正确的是
| A.197>Q1>Q2 | B.Q1>2Q3 | C.Q1=Q4 | D.Q3<Q4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 nC(g)(正反应放热),在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图所示,其中结论正确的是( )
nC(g)(正反应放热),在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图所示,其中结论正确的是( )
| A.p1>p2,n>3 |
| B.p1<p2,n>3 |
| C.p1<p2,n<3 |
| D.p1>p2,n=3? |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g) △H<0,450℃时,n(SO3)和n(O2)随时间的变化关系如图所示,下列说法正确的是
2SO3(g) △H<0,450℃时,n(SO3)和n(O2)随时间的变化关系如图所示,下列说法正确的是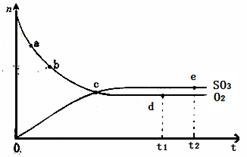
| A.点c处反应达到平衡 |
| B.点a的正反应速率比点b的大 |
| C.点d (t1时刻)和点e (t2时刻)处n(SO2)不一样 |
| D.其他条件不变,600℃时反应至t1时刻,n(SO 3)比上图中的d点值要大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
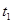 s后达平衡。如图:
s后达平衡。如图:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
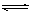 PCl5(g)达到平衡时,PCl5为0.40mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是
PCl5(g)达到平衡时,PCl5为0.40mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是| A.0.40mol | B.小于0.20mol | C.0.20mol | D.大于0.20mol,小于0.40mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是A.K= |
B.K=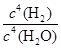 |
| C.增大c(H2O)或减小c(H2),会使该反应平衡常数减小 |
| D.改变反应的温度,平衡常数不一定变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
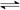 2NH3(g) △H = -92 kJ·mol-1
2NH3(g) △H = -92 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com