
| A、等物质的量的甲与乙的质量之比等于n:m |
| B、等质量的甲与乙的分子个数之比等于n:m |
| C、同温同体积时,等质量的甲与乙的压强之比等于n:m |
| D、常温常压下,等质量的甲与乙的体积之比等于m:n |
| m |
| V |
| nM |
| nVm |
| M |
| Vm |
| 1 |
| m |
| 1 |
| n |
| 1 |
| m |
| 1 |
| n |
| 1 |
| m |
| 1 |
| n |


科目:高中化学 来源: 题型:
| A、若B(OH)m 是强碱,则A(OH)m一定为强碱 |
| B、若HnAOm是强酸,则B的最高价氧化物对应的水化物一定为强酸 |
| C、若B是金属,则A可能是非金属,若B是非金属,则A可能是金属 |
| D、常温下,若B元素的氢化物是气体,则A元素的氢化物可能是液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、质量相等密度不等的N2和C2H4 |
| B、等体积等密度的CO和C2H4 |
| C、等温、等压,等体积的O2和N2 |
| D、标准状况下,等质量的NO和CO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、103 |
| B、10-2 |
| C、10-3 |
| D、2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、XY |
| B、XY2 |
| C、XY3 |
| D、X2Y2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 1 | 2 | 3 |
| m(混合物)/g | 4.6 | 7.2 | 7.9 |
| V(CO2)(标准状况)/L | 1.12 | 1.68 | 1.68 |
| A、根据实验1中的数据可以计算出盐酸的浓度 |
| B、混合物中NaHCO3的质量分数约为45.7% |
| C、根据第2、3组数据可以分析出第2组中的混合物完全反应 |
| D、盐酸的物质的量浓度为1.5mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
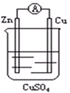
| A、电子从锌电极通过电流表流向铜电极 |
| B、锌电极发生还原反应,铜电极发生氧化反应 |
| C、当有13g Zn溶解时,电路中就有0.5 mol电子通过 |
| D、铜电极做正极发生的电极反应为2 H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:2 | B、2:3 |
| C、2:1 | D、1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用丁达尔效应区分溶液与胶体 |
| B、生石灰与水混合的过程只发生物理变化 |
| C、FeCl3溶液和Fe(OH)3胶体的分散质颗粒直径相同 |
| D、冰水混合物属于混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com