

分析 (1)根据MnFe2O4的制备流程,可知Mn、Fe的化合价未变,Mn(NO3)2中Mn的化合价为+2,则MnFe2O4中Fe的化合价为+3,从而求出Fe(NO3)n中的n,
由MnFe2O4中可知:Fe和Mn的个数之比为2:1,根据质量守恒,求出原料Fe(NO3)n和Mn(NO3)2的质量之比;
(2)根据搅拌的通常目的和判断沉淀是否洗涤干净的方法来解答;
(3)①根据化合价代数和为0,计算MnFe2O4-x中铁的总价态,1mol MnFe2O4-0.6中含Fe2+、Fe3+物质的量分别为xmol、ymol,列方程组解答;
②从可操作性、环保以及原料的价格等方面分析;
③改进方法可从流程简洁方面考虑.
解答 解:(1)Mn为+2价,则MnFe2O4中Fe的化合价为+3价,则Fe(NO3)n中n=3;
由MnFe2O4中可知:Fe和Mn的个数之比为2:1,所以Fe(NO3)3与Mn(NO3)2 二者的物质的量之比 2:1,
所以其质量之比为:242×2:179=484:179;
故答案为:3;484:179;
(2)连续搅拌是为了让Fe(NO3)n和Mn(NO3)2充分反应,由于溶液显碱性,则洗涤至洗涤液为中性时,说明沉淀上没有溶液中的离子,即沉淀已经洗涤干净;
故答案为:充分反应或沉淀完全;最后一次洗涤液呈中性;
(3)①x=0.6时,铁的总价态为(4-0.6)×2-2=4.8,
设1mol MnFe2O4-0.6中含Fe2+、Fe3+物质的量分别为xmol、ymol,
则有x+y=2,2x+3y=4.8,联立解得:x=1.2,y=0.8,
则1mol MnFe2O4-0.8中含Fe2+的物质的量为1.2mol,则Fe2+占的百分率为$\frac{1.2mol}{2mol}$×100%=60%.
故答案为:60%;
②由流程图可以看出过程简单、节约能量、无污染、物料廉价并可循环使用及氧气和氢气在不同步骤生成,不存在高温气体分离的问题等,
故答案为:过程简单、节约能量、无污染、物料廉价并可循环使用及氧气和氢气在不同步骤生成,不存在高温气体分离的问题等(答两点即可);
③因高温消耗较多的能源,则寻找合适的催化剂,使MnFe2O4分解温度降低或分解温度更低的氧化物,
故答案为:寻找合适的催化剂,使MnFe2O4分解温度降低或分解温度更低的氧化物.
点评 本题以MnFe2O4的制备为载体,考查学生对工艺流程的理解、对实验操作的理解、化学式有关计算等,难度中等,综合性较强,涉及的知识点多,需要学生具备阅读分析能力和灵活运用知识的解决问题能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.45 mol/(L•s) | B. | 0.15 mol/(L•s) | C. | 0.225 mol/(L•s) | D. | 0.9 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
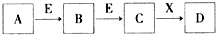
| A. | 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是氯气 | |
| B. | 若D是一种强碱,则A、B、C均可与X反应生成D | |
| C. | 若D为NaCl,且A可与C反应生成B,则E一定是CO2 | |
| D. | 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 未用标准液润洗碱式滴定管 | |
| B. | 滴定终点读数时,俯视滴定管的刻度 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 | |
| D. | 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3N4晶体是分子晶体 | |
| B. | C3N4晶体中,C原子采用sp3杂化,氮原子采用sp2杂化 | |
| C. | C3N4晶体中,C-N键的键长比金刚石中的C-C键的键长要短 | |
| D. | C3N4晶体中存在配位键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com