解答:
解:(1)①方案一 托盘天平的过量是0.1g,电子天平的感量是0.001g,所以称量药品时用电子天平,称量容器和称量容器和药品各一次,当前后两次称量的质量差不超过0.001g时说明已经达到恒重,至少需要两次,故至少需要4次称量;固体灼烧应放在坩埚中进行,
故答案为:电子天平;4;坩埚;
②碳酸氢钠受热分解使固体质量减少,当恒重时说明碳酸氢钠完全分解;当前后两次称量的质量差不超过0.001g时说明已经达到恒重;
故答案为:判断碳酸氢钠完全分解;0.001;
③令原混合物中碳酸氢钠的质量为xg,样品质量为:14.200g-11.200g-=3.000g,固体质量减少为:14.200g-13.580g=0.62g,则:
2NaHCO
3Na
2CO
3+H
2O+CO
2↑ 固体减少
168 106 62
xg 0.62g
所以168:62=xg:0.62g,解得:x=1.68,故碳酸氢钠的质量分数ω(NaHCO
3)=
×100%=56%,
A、混合物中含有加热易分解的物质.加热后分解,导致质量差变大,计算结果偏高,故A错误;
B、最后两次加热后质量相差较大说明结晶水还没有完全失去,会导致测定结果偏小,故B正确;
C、加热后容器未放入干燥器中冷却会导致测定的质量差变小,故C正确;
D、加热过程中晶体有少量溅失会导致测定的质量差变大,故D错误;
故答案为:56%;BC;
(2)方案二①甲基橙的变色范围是3.1-4.4,碳酸钠溶液呈碱性,所以滴有甲基橙的碳酸钠溶液呈黄色,当滴定终点时,溶液呈酸性,溶液黄色恰好变成橙色,且半分钟内不褪色,
故答案为:黄色恰好变成橙色,且半分钟内不褪色;
②图示读数为20.10mL,碳酸氢钠和盐酸反应方程式为:NaHCO
3+HCl=NaCl+H
2O+CO
2↑,
n(NaCO
3)=n(HCl)=0.0201L×0.100mol/L=0.00201mol,4.425g样品含碳酸氢钠的质量为:0.00201mol×
×84g/mol=3.3768g,碳酸氢钠的质量分数为:
×100%=76.31%,故答案为:20.10mL;76.31%;
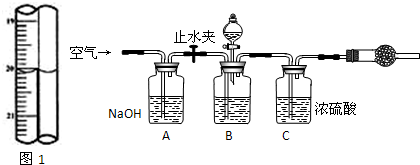
(3)①空气中含有二氧化碳,A中氢氧化钠溶液用于吸收空气中二氧化碳,防止干扰碳酸氢钠的测定;反应生成的二氧化碳中含有水蒸气,碱石灰能吸收水蒸气而影响二氧化碳的测定,所以用C装置中的浓硫酸吸收水蒸气;
故答案为:除去空气中的二氧化碳;干燥二氧化碳气体;
②空气中的水蒸气和二氧化碳进入干燥管而影响二氧化碳的测定,使测得二氧化碳质量偏大,由此计算碳酸氢钠质量分数偏大;为防止空气中水蒸气和二氧化碳的干扰,应该在干燥管右边再加一个装有碱石灰的干燥管,
故答案为:偏大;在干燥管右边再加一个装有碱石灰的干燥管;
③碱石灰吸收的物质是二氧化碳,二氧化碳的质量是(W
3-W
1)g,根据碳原子守恒得碳酸氢钠的质量=
g,则碳酸氢钠的质量分数=
×100%,故答案为:
×100%.



 ﹙1﹚在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图1.
﹙1﹚在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图1.

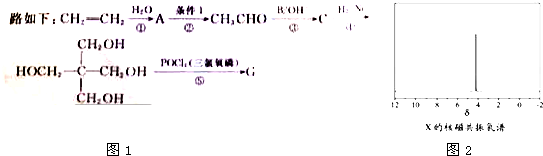

 )与
)与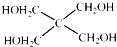 以物质的量之比2:1反应时,生成G,并释放出一种酸性气体,G的核磁共振氢谱如图2所示.
以物质的量之比2:1反应时,生成G,并释放出一种酸性气体,G的核磁共振氢谱如图2所示.