
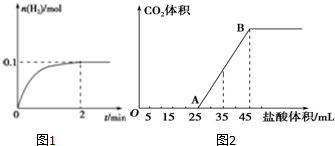
分析 (1)①依据化学反应速率计算V=$\frac{△c}{△t}$;
②A.升温反应速度加快,平衡也发生移动; B.扩大容器容积,相当于减小压强;C.使用催化剂,反应速度加快,但平衡不发生移动; D.充入He气体,各组分的浓度不变,平衡不移动;
(2)①结合图象可知,开始没有二氧化碳气体生成,而且OA>AB,所以溶质为碳酸钠和氢氧化钠,则OA段先发生酸碱中和,再发生碳酸钠与盐酸反应生成碳酸氢钠与氯化钠;
②结合图象可知,当加入35mL盐酸时,25~35mL发生碳酸氢钠与盐酸的反应生成二氧化碳气体.
解答 解:(1)根据图象可知,0-2 min内,氢气的物质的量增加了0.1mol,则必然消耗HI是0.2mol,使用平均反应速率v(HI)=$\frac{0.2mol}{1L×2min}$=0.1 mol/(L•min),故答案为:0.1mol/(L•min);
②A.升温反应速度加快,平衡也发生移动,故不选; B.扩大容器容积,相当于减小压强,反应速率减慢,平衡不移动,故不选;C.使用催化剂,反应速度加快,但平衡不发生移动,故符合; D.充入He气体,各组分的浓度不变,反应速率不变,平衡不移动,故不选;
故选C;
(2)①结合图象可知,开始没有二氧化碳气体生成,而且OA>AB,所以溶质为碳酸钠和氢氧化钠,则OA段先发生酸碱中和,再发生碳酸钠与盐酸反应生成碳酸氢钠与氯化钠,故答案为:NaOH、Na2CO3;
②结合图象可知,当加入35mL盐酸时,25~35mL发生碳酸氢钠与盐酸的反应生成二氧化碳气体,
设生成二氧化碳的物质的量为n,生成气体时消耗的酸的物质的量为(35-25)×10-3L×1mol•L-1=0.01mol,则
HCO3-+H+═CO2↑+H2O
1 1
0.01mol n
$\frac{1}{0.01mol}=\frac{1}{n}$,解得n=0.01mol,标准状况下其体积为0.01mol×22.4L/mol=0.224L=224mL,
故答案为:224.
点评 本题考查学生利用图象和发生的离子反应来分析解答问题,明确反应的先后顺序及图象中每段图象对应的化学反应是解答本题的关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中得到6.72 L的气体(标况) | |
| B. | 最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) | |
| C. | 最终得到7.8 g的沉淀 | |
| D. | 最终得到的溶液中c(NaCl)=2.0 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2 )和H2的平衡转化率均增大 | |
| D. | 500℃、30Mpa下,将0.5molN2和1.5molH2置于密闭容器中充分反应,放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.
有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使石蕊溶液变红的溶液中:MnO4-、NO3-、SO42-、Na+、SO32- | |
| B. | 加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、SO42- | |
| C. | 使pH试纸变深蓝的溶液中:CO32-、NO3-、Na+、S2-、AlO2-、SO32- | |
| D. | pH=1的溶液中:Fe2+、Al3+、NO3-、I-、Cl-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
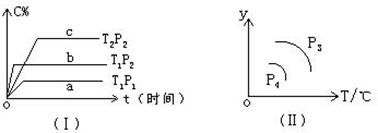
| A. | P3>P4,y轴表示A的转化率 | |
| B. | P3>P4,y轴表示B的质量分数 | |
| C. | P3>P4,y轴表示混合气体密度 | |
| D. | P3<P4,y轴表示混合气体的平均相对分子质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com