
| A. | 苯和乙烯均含有碳碳双键,均可使溴的CCl4溶液褪色 | |
| B. | 苯( )的一氯代物有一种,丙烷的一氯代物也有一种 )的一氯代物有一种,丙烷的一氯代物也有一种 | |
| C. | 乙醇和乙烯均可与酸性高锰酸钾发生反应 | |
| D. | 所有的有机物都很容易燃烧 |
分析 A.苯不含碳碳双键,乙烯含碳碳双键;
B.苯环上只有一种H,丙烷含2种H;
C.乙醇含-OH,乙烯含碳碳双键;
D.四氯化碳为有机物,不能燃烧.
解答 解:A.苯不含碳碳双键,乙烯含碳碳双键,则只有乙烯使溴的CCl4溶液褪色,故A错误;
B.苯环上只有一种H,丙烷含2种H,则一氯代物分别为1、2种,故B错误;
C.乙醇含-OH,乙烯含碳碳双键,均能被高锰酸钾氧化,则均可与酸性高锰酸钾发生反应,故C正确;
D.四氯化碳为有机物,不能燃烧,而烃、烃的含氧衍生物均可燃烧,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意官能团及结构对称性判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
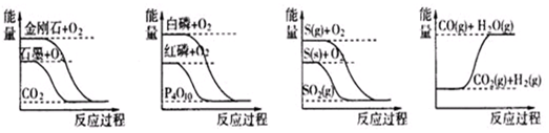
| A. | 石墨转变为金刚石是吸热反应 | |
| B. | 相同条件下,白磷比红磷稳定 | |
| C. | 相同条件下,等质量S(g)和S (s)的能量比较,S (s)能量较高 | |
| D. | CO(g)+H2O(g)=CO2(g)+H2 (g)是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe与Cl2反应生成FeCl3,则Fe与I2反应可生成FeI3 | |
| B. | Al(OH)3、Cu(OH)2受热易分解,则Fe(OH)3受热也易分解 | |
| C. | Na可与冷水反应产生氢气,K也可与冷水反应生成氢气 | |
| D. | CO2可以使澄清的石灰水变浑浊,SO2也可以使澄清的石灰水变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 农药波尔多液不能用铁制器皿盛放 | |
| B. | 维生素C能帮助人体将摄取的Fe3+还原为Fe2+,这说明维生素C有还原性 | |
| C. | 用硫酸可以洗去锅炉水垢 | |
| D. | 氮气常用作保护气,如填充灯泡、焊接保护等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ③⑤⑥ | C. | ②④⑥ | D. | ①②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义.
研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com