
【题目】某密闭容器中,有A.B两种气体,反应按下式进行A(g)+B(g)═2C(g)反应经过2S后浓度不再发生变化时,测得容器中各物质的浓度分别为c(A)=0.5mol/L,c(B)=0.75mol/L,c(C)=0.5mol/L.
(1)B物质的起始浓度为
(2)2S时A的转化率
(3)用物质A表示反应的平均速率 .
【答案】
(1)1mol/L
(2)33.3%
(3)0.125mol/(L.s)
【解析】解:(1)由方程式可知△c(B)= ![]() △c(C)=
△c(C)= ![]() ×0.5mol/L=0.25mol/L,B的起始浓度=0.75mol/L+0.25mol/L=1mol/L,所以答案是:1mol/L;(2)由方程式可知△c(A)=
×0.5mol/L=0.25mol/L,B的起始浓度=0.75mol/L+0.25mol/L=1mol/L,所以答案是:1mol/L;(2)由方程式可知△c(A)= ![]() △c(C)=
△c(C)= ![]() ×0.5mol/L=0.25mol/L,A的转化率=
×0.5mol/L=0.25mol/L,A的转化率= ![]() ×100%=33.3%,所以答案是:33.3%;(3)用A表示反应的平均速率v(A)=
×100%=33.3%,所以答案是:33.3%;(3)用A表示反应的平均速率v(A)= ![]() =0.125mol/(L.s),所以答案是:0.125mol/(L.s).
=0.125mol/(L.s),所以答案是:0.125mol/(L.s).
【考点精析】利用化学平衡的计算对题目进行判断即可得到答案,需要熟知反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】(1)下图所示元素周期表中全部是金属元素的区域为___________
A.A B.B C.C D.D

(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。______________
②甲、乙两元素相比较,金属性较强的是_________(填名称),可以验证该结论的实验是_______。
A.将在空气中放置很久的这两种元素的块状单质分别放入热水中
B.将这两元素的单质粉末分别和同浓度的盐酸反应
C.将这两元素的单质粉末分别和热水作用,并滴入酚酞
D.比较这两种元素的气态氢化物的稳定性
(3)上表中所列某些元素间能形成等电子的A、B、C、D、E五种微粒,A与C组成元素相同,B、E、D组成元素相同,它们间能发生如下反应:A+B=C+D,E+B=2D,则写出B的电子式:______,比较C、B、D结合氢离子的能力由强到弱的顺序为_________________(用化学式表示)。
(4)上表中c、h元素形成的简单离子半径之比________ 1(填〉或〈或 =)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列提纯物质方法正确的是( )
A.用BaCl2溶液除去HNO3溶液中的少量H2SO4
B.用NaOH溶液除去铝粉中的少量铁粉
C.用氯水除去FeCl2溶液中的少量FeCl3
D.用加热法除去NaCl固体中的少量NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2 . CO等大气污染气体的处理具有重要意义.
(1)NO2可用水吸收,相应的化学反应方程式为
利用反应6NO2+8NH3 ![]() 7N2+12H2O也可处理NO2 . 当转移1.2mol电子时,消耗的NO2在标准状况下是 L.
7N2+12H2O也可处理NO2 . 当转移1.2mol电子时,消耗的NO2在标准状况下是 L.
(2)已知:2SO2(g)+O2(g)![]()
![]() 2SO3(g)△H=﹣196.6kJmol﹣1
2SO3(g)△H=﹣196.6kJmol﹣1
2NO(g)+O2(g)═2NO2(g)△H=﹣113.0kJmol﹣1
则反应SO2(g)+NO2(g)=SO3(g)+NO(g)的△H=kJmol﹣1
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO2和NO的体积比保持不变 D.每消耗1molSO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图所示.该反应△H0(填“>”或“<”)实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 . 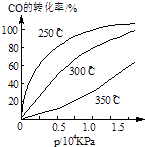
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对含有Al3+的未知溶液进行了如下分析:
(1)滴加少量NaOH溶液,无明显变化;
(2)继续滴加NaOH溶液,有白色胶状沉淀生成;
(3)滴加过量的NaOH溶液,白色胶状沉淀明显减少。
实验小组经定量分析,得出如图所示沉淀的物质的量与滴加NaOH溶液体积的关系。下列说法错误的是 ( )
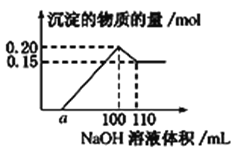
A. 该未知溶液中至少含有3种阳离子
B. NaOH溶液的物质的量浓度为5 mol·L-1
C. 若另一种离子为二价阳离子,则a=40
D. 若将最终沉淀过滤、洗涤、灼烧,其质量可能为6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂。某兴趣小组用如图所示装罝制备NaNO2并对其性质作如下探究(A中加热装罝已略去)。
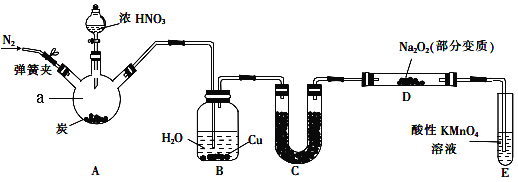
查阅资料可知:
① 2NO+Na2O2![]() 2NaNO2;2NO2+Na2O2
2NaNO2;2NO2+Na2O2![]() 2NaNO3。
2NaNO3。
② NO能被酸性KMnO4氧化成NO3。
(1)装置中仪器a的名称为____________,A中反应的化学方程式是______________________。
(2)装置B中观察到的主要现象是____________________________________________________。
(3)装置C中盛放的试剂是__________________________。
(4)装置E的作用是_______________。
(5)A中滴入浓硝酸之前,应先通入N2一段时间,原因是__________________________________。
(6)写出NO被酸性KMnO4氧化的离子反应方程式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如图所示,下列说法正确的是( ) 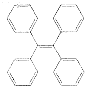
A.该有机物的分子式为C26H22
B.该有机物属于苯的同系物
C.该有机物的一氯代物有4种
D.该有机物既可发生氧化反应,又可发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1mol/L稀醋酸加水稀释,如图中的纵坐标y可以是( ) 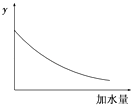
A.溶液的pH
B.醋酸的电离平衡常数
C.溶液的导电能力
D.醋酸的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用纯溴和苯在铁离子催化下反应制取溴苯,得到粗溴苯后,要用如下操作精制,正确的操作顺序是( ) ①蒸馏 ②水洗分液 ③用干燥剂干燥 ④10%NaOH溶液洗分液
A.①②③④②
B.②④②③①
C.④②③①②
D.②④①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com