
化合物E是一种医药中间体,常用于制备抗凝血药,可以通过下图所示的路线合成:
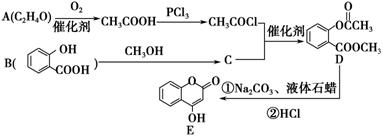
(1)A中含有的官能团名称为________。
(2)C转化为D的反应类型是________。
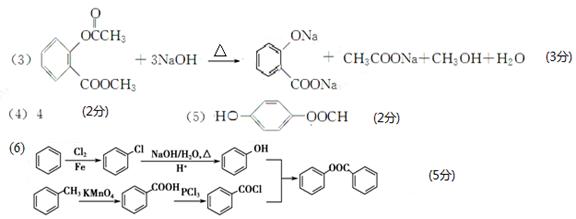
(3)写出D与足量NaOH溶液完全反应的化学方程式:____________________。
(4)1 mol E最多可与________mol H2加成。
(5)写出同时满足下列条件的B的一种同分异构体的结构简式:____________。
A.能发生银镜反应 B.核磁共振氢谱只有4个峰
C.能与FeCl3溶液发生显色反应,水解时1 mol可消耗3 mol NaOH
(6)已知工业上以氯苯水解制取苯酚,而酚羟基一般不易直接与羧酸酯化。苯甲酸苯酚酯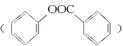 是一种重要的有机合成中间体。试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。合成路线流程图示例如下:
是一种重要的有机合成中间体。试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。合成路线流程图示例如下:
H2C==CH2 CH3CH2Br
CH3CH2Br CH3CH2OH
CH3CH2OH
【知识点】有机物的推断、有机物分子中的官能团及其结构、有机合成
【答案解析】(1)醛基(2分) (2)取代反应 (1分)
 解析:(1)由A催化氧化产物是乙酸知A是乙醛CH3CHO,官能团名称是醛基;(2)B与甲醇发生酯化反应,生成C,结构简式为:
解析:(1)由A催化氧化产物是乙酸知A是乙醛CH3CHO,官能团名称是醛基;(2)B与甲醇发生酯化反应,生成C,结构简式为: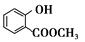 ,C与
,C与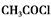 在催化剂存在下生成
在催化剂存在下生成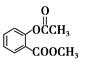 ,反应类型是取代反应;(3)D中含有两个酯基,其中一个酯基水解后产生的酚羟基又会和氢氧化钠反应,总反应方程式为:
,反应类型是取代反应;(3)D中含有两个酯基,其中一个酯基水解后产生的酚羟基又会和氢氧化钠反应,总反应方程式为:
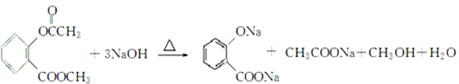
(4)E是 ,苯环和一个碳碳双键和氢气加成,所以,1 mol E最多可与4mol H2加成;(5)同时满足条件的B的同分异构体,能发生银镜反应,说明含有醛基;能与FeCl3溶液发生显色反应,水解时1 mol可消耗3 mol NaOH,说明含有酚羟基、酯基,酯的水解产物也含有酚羟基,综上,应该是一个酚羟基、一个甲酸酯基;核磁共振氢谱只有4个峰,说明这两种官能团处于苯环的对位,结构简式为:
,苯环和一个碳碳双键和氢气加成,所以,1 mol E最多可与4mol H2加成;(5)同时满足条件的B的同分异构体,能发生银镜反应,说明含有醛基;能与FeCl3溶液发生显色反应,水解时1 mol可消耗3 mol NaOH,说明含有酚羟基、酯基,酯的水解产物也含有酚羟基,综上,应该是一个酚羟基、一个甲酸酯基;核磁共振氢谱只有4个峰,说明这两种官能团处于苯环的对位,结构简式为: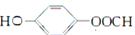 ;
;
(6)酚羟基一般不易直接与羧酸酯化,运用“C与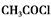 在催化剂存在下生成
在催化剂存在下生成 ”原理来得到苯甲酸苯酚酯
”原理来得到苯甲酸苯酚酯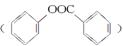 ,以苯、甲苯为原料制取该化合物的合成路线流程图如下:
,以苯、甲苯为原料制取该化合物的合成路线流程图如下:
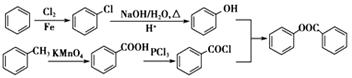
【思路点拨】本题考查有机物的推断,题目难度中等,本题注意把握题给信息,以正逆推相结合的方法推断,明确各物质的种类为解答该题的关键,注意官能团的性质。


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
反应A(g)+3B(g)===2C(g)+2D(g),在不同情况下测得的反应速率如下,其中反应速率最大的是( )
A.v(D)=0.4 mol·L-1·s-1 B.v(C)=0.5 mol·L-1·s-1
C.v(B)=0.6 mol·L-1·s-1 D.v(A)=0.15 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)
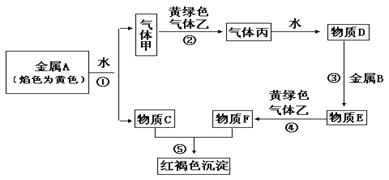
请回答下列问题:
(1)A的化学式为 ,丙的化学式为 ;
(2)写出下列反应的离子方程式:
① ;
④ ;
⑤ 。
(3)写出C溶液与Al反应的化学方程式: 。
(4)将Na2O2投入到E溶液中,可以观察到的现象是: 。
(5)为鉴定B单质,将试样溶于稀盐酸,取上层清液后需再加入的试剂(填写字母代号)是 。
a. 碘水 b. 氯水 c. NaOH溶液 d. KSCN溶液 e. Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表。
| 化合物 | 相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
(一)乙酸正丁酯的制备
①在干燥的50mL圆底烧瓶中,加入13.5mL正丁醇和7.2mL冰醋酸,再加入3~4滴浓硫酸,摇匀,投入1~2粒沸石。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应
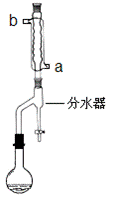
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用10 mL的水洗涤。有机层继续用10 mL10%Na2CO3洗涤至中性,再用10 mL 的水洗涤,最后将有机层转移至锥形瓶中,再用无水硫酸镁干燥。
③将干燥后的乙酸正丁酯滤入50 mL 烧瓶中,常压蒸馏,收集125~127 ℃的馏分,得11.6 g乙酸正丁酯
请回答有关问题。
(1)冷水应该从冷凝管 ___________(填a或b)管口通入。
(2)步骤①中不断从分水器下部分出生成的水的目的是_________________________
步骤①中判断反应终点的依据是_____________________________________。
(3)产品的精制过程步骤②中,第一次水洗的目的是_____________________________,用饱和Na2CO3溶液洗涤有机层,该步操作的目的是_________________________________。
(4)下列关于分液漏斗的使用叙述正确的是____
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.装液时,分液漏斗中液体的总体积不得超过其容积的2/3
C.萃取振荡操作应如右图所示
D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
(5)步骤③的常压蒸馏,需收集126℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是_________________________
(6)该实验过程中,生成乙酸正丁酯(式量116)的产率是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
关于某有机物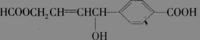 的性质叙述正确的是 ( )
的性质叙述正确的是 ( )
A、1 mol该有机物可以与3 mol Na发生反应、
B、1 mol该有机物可以与3 mol NaOH发生反应
C、1 mol该有机物可以与6 mol H2发生加成反应
D、1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为长式周期表的一部分,其中的序号代表对应的元素。
| ① |
| ||||||||||||||||
|
| ② |
| ③ | ④ | ⑤ | ⑥ |
| ||||||||||
|
| ⑦ |
| ⑧ |
|
|
|
| ||||||||||
|
|
|
|
|
| ⑨ |
|
|
|
| ⑩ |
|
|
|
|
|
|
|
(1)写出上表中元素⑤的轨道表示式_______,元素⑨原子的核外电子排布式__________。
(2)元素第一电离能的大小比较:④_____⑤(填写“>”“=”或“<”,下同);元素电负性的大小比较:④_____⑤(填写“>”“=”或“<”);请写出与元素④的单质互为等电子体的一种微粒的化学式_________。
(3)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是__________。
(4)上述③与④元素组成的(CN)2化合物中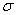 键与
键与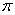 键之比________。
键之比________。
(5)⑦的氧化物是优良的耐高温材料,它的熔点比 CaO高,其原因是_____________。
(6)元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则该氧化物的化学式________。
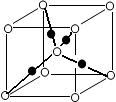
查看答案和解析>>
科目:高中化学 来源: 题型:
具有下列电子排布式的原子中,半径最大的是 ( )
A ls22s22p63s23p5 B 1s22s22p63s23p2 C 1s22s22p2 D 1s22s22p63s23p4
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA
B. 常温常压下,28 g C2H4、C O的混合气体中含有碳原子的数目为1.5NA
O的混合气体中含有碳原子的数目为1.5NA
C.常温下,20 L pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA
D. 标准状况下,2.24 L Cl2与足量的NaOH溶液反应,转移的电子数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产、生活联系密切,下列说法正确的是
A.常用作净水剂的KAl(SO4)2和漂白粉都是强电解质
B.氯气溶于水生成的次氯酸具有强氧化性,可以起到除去水中杂质和杀菌消毒作用
C.氮氧化物可以破坏臭氧层,也能形成酸雨
D.“玉兔”月球车太阳能电池板可将光能转换为电能,所用转换材料是二氧化硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com