
原子结构决定元素的性质,下列说法中正确的是
A.Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小,
B.在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的其沸点也一定最高
C.第二周期元素的最高正化合价都等于其原子的最外层电子数
D.非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源:2015-2016学年云南省高一下期中化学试卷(解析版) 题型:选择题
有下列两种转化途径,某些反应条件和产物已省略。下列有关说法不正确的是
途径① S H2SO4
H2SO4
途径② S SO2
SO2 SO3
SO3 H2SO4
H2SO4
A.途径①反应中体现了浓硝酸的强氧化性和酸性
B.途径②的第二步反应在实际生产中可以通过增大O2浓度来降低成本
C.由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol e-
D.途径②与途径①相比更能体现“绿色化学”的理念是因为途径②比途径①污染相对小且原子利用率高
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:填空题
【选做题】本题包括A, B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分
A.在5-氨基四唑(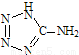 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
(1)基态Ga原子的电子排布式可表示为____________;
(2)5-氨基四唑中所含元素的电负性由大到小的顺序为____________,其中N原子的杂化类型为____________;在1mol 5-氨基四唑中含有的σ键的数目为____________。
(3)叠氮酸钠(NaN3)是传统安全气囊中使用的气体发生剂.
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为____________。
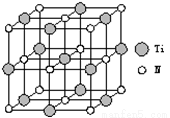
②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物.其结构是用碳原子取代氮化钛晶胞(结构如右图)顶点的氮原子,这种碳氮化钛化合物的化学式为____________。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:选择题
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15, X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径:W>Z>Y>X>M
B.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
C.XZ2, X2M2, W2Z2均为直线型的共价化合物
D.由X元素形成的单质不一定是原子晶体
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三第五次模拟理综化学试卷(解析版) 题型:填空题
氢气是清洁的能源,也是重要的化工原料,根据以下两种制氢方法。完成下列问题:
(1)方法一:H2S热分解法,反应式为:2H2S(g) 2H2(g)+S2(g)△H
2H2(g)+S2(g)△H
在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为cmol/L),测定结果见右图,图中曲线a表示H2S的平衡转化率与温度关系,曲线表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
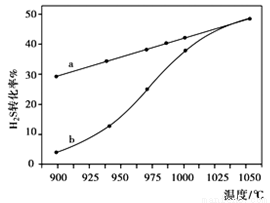
①△H______0,(“>”、“<”或“=”),
②若985℃时,反应经tmin达到平衡,此时H2S的转化率为40%,则tmin内反应速率v(H2)=______(用含c、t的代数式表示)。
③请说明随温度的升高,曲线b向曲线a接近的原因:______。
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2.相关主要反应如下:
I:C(s)+H2O(g)═CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g) △H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)═CaCO3(s) △H=-178.3kJ/mol
①计算反应C(s)+2H2O(g)+CaO(s)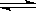 CaCO3(s)+2H2(g)的△H=______;
CaCO3(s)+2H2(g)的△H=______;
若K1、K2、K3分别为反应I、Ⅱ、Ⅲ的平衡常数,该平衡常数K=_____________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s)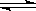 CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是______。(填字母编号)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是______。(填字母编号)
A.降低体系的温度
B.压缩容器的体积
C.适当增加水蒸气的通入量
D.增加CaO的量
③下图为反应I在一定温度下,平衡时各气体体积百分含量随压强变化的关系图。若反应达某一平衡状态时,测得c(H2O)=2c(H2)=2c(CO)=2mol/L,试根据H2O的体积百分含量变化曲线,补充完整CO的变化曲线示意图。

查看答案和解析>>
科目:高中化学 来源:2016届湖北省黄冈市高三5月一模理综化学试卷(解析版) 题型:推断题
X、Y、Z、P、Q为周期表前四周期中原子序数依次增大的元素。X原子2p能级有两个未成对电子,但没有空轨道。Y原子K层的电子数与M层的电子数的乘积等于其L层的电子数。Z与X同族。P原子的基态+2价阳离子的价电子排布为3d2。Q位于第ⅠB族。根据以上信息,回答下列问题。
(1)X的基态原子核外有 种不同运动状态的电子。
(2)Y与X可以形成多种复杂阴离子,如图所示,若其中a对应的阴离子化学式为SiO44—,则c对应的阴离子的化学式为 。

(3)Z能形成很多种含氧酸,如H2ZO3、H2ZO4。Z的某种含氧酸分子式为H2Z2O7,属于二元酸,已知其结构中所有原子都达到稳定结构,且不存在非极性键,试写出其结构式 (配位键须注明)。
(4)P与X形成的某种晶体的晶胞结构如图所示,其晶体的化学式为 ,P的配位数为 。

(5)向盛有QZX4的溶液中加入氨水至过量,现象为 ,相关反应的离子方程式为 。NF3的空间构型是 ,NF3不易与Cu2+形成配离子,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省黄冈市高三5月一模理综化学试卷(解析版) 题型:选择题
下列有关实验操作及原理正确的是( )
A.用玻璃棒蘸取NaClO溶液,点在干燥的pH试纸上,证明HClO是弱酸。
B.将一定量的FeCl3晶体、盐酸依次加入容量瓶中,配制一定物质的量浓度的FeCl3溶液
C.将Cu与浓硫酸反应剩余的液体加入到盛有蒸馏水的烧杯中,以证明反应生成了CuSO4
D.用乙醇、乙酸制取乙酸乙酯的过程中发现忘加碎瓷片,可立即补加
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古杭锦后旗奋斗中学高二下期中化学卷(解析版) 题型:选择题
将0.1mol/L醋酸溶液加水稀释,下列说法正确的是( )
A. 溶液中c(H+)和c(OH-)都减小
B. 溶液中c(H+)增大
C. 醋酸电离平衡向左移动
D. 溶液的pH增大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆兵团农二师华山中学高一下期中化学卷(解析版) 题型:填空题
如下图中A、B、C、D分别代表有关反应中的一种化合物,其中物质A是一种高熔点化合物,不溶于硫酸、硝酸,却溶于氢氟酸。请填写以下空白。

(1)A、B、C、D的化学式分别是___________、___________、___________、___________。
(2)A→B的化学方程式是________________________________________________________。
(3)C→D的离子方程式是________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com