
【题目】常温下,向20mL 0.1mol·L-1氨水中滴加某浓度的硫酸溶液,溶液中水电离的c(H+)随加入硫酸的体积变化如图所示。下列说法不正确的是

A.若a点对应水电离的c(H+)=1.0×10-11mol·L-1,则此时氨水的电离程度为1%
B.c点时氨水与硫酸恰好完全反应
C.c点对应溶液中:c(H+)-c(OH-)=c(NH3·H2O)
D.若b、d点对应水电离的c(H+)=1.0×10-7mol·L-1,则两溶液中均存在:c(NH4+)=2c(SO42-)
【答案】D
【解析】
A.水电离的氢离子浓度为1.0×10-11 molL-1,由Kw可知溶液中的氢氧根离子的浓度为1.0×10-3 molL-1,则氨水的电离度为![]() ×100%=1%,故A正确;
×100%=1%,故A正确;
B.c点水的电离程度最大,说明恰好生成硫酸铵,即c点时氨水与硫酸恰好完全反应,故B正确;
C.c点溶液中溶质为硫酸铵,溶液中质子守恒为c(H+)═c(NH3H2O)+c(OH-),则c(H+)-c(OH-)═c(NH3H2O),故C正确;
D.c点硫酸与氨水恰好反应,则b点硫酸不足,d点硫酸过量,溶液中氢离子浓度大于1.0×10-7 molL-1,d点时:c(NH4+)≠2c(SO42-),故D错误。
故选:D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法不正确的是( )
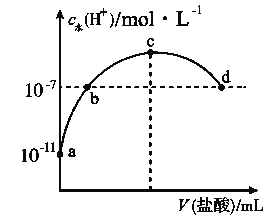
A. 常温下,0.1 mol·L-1氨水中![]() 的电离常数
的电离常数![]() 约为
约为![]()
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)<c(Cl-)
D. b点代表溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,![]() ,
,![]() 。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.![]() 的
的![]() 溶液:
溶液:![]()
B.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液混合
溶液混合![]() :
:![]()
C.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液等体积混合:
溶液等体积混合:![]()
D.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液等体积混合:
溶液等体积混合:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标明下列反应电子转移情况,并根据要求回答问题。
(1)3NO2+H2O=2HNO3+NO_______
(2)氧化剂____________还原剂____________氧化产物____________还原产物__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g),下列说法正确的是
CH3OH(g),下列说法正确的是
容器 | 温度/K | 物质的平衡浓度/mol/L | |||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | |
III | 500 | 0 | 0 | 0.10 | 0.025 |
A.该反应的正反应吸热
B.达到平衡时,容器I中反应物转化率比容器II中的大
C.达到平衡时,容器II中c(H2)大于容器I中c(H2)的两倍
D.达到平衡时,容器III中的反应速率比容器I中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚苯胺是一种在充放电过程中具有更优异可逆性的电极材料。Zn一聚苯胺二次电池的结构示意图如图所示,设NA为阿伏加德罗常数的值。下列说法错误的是( )
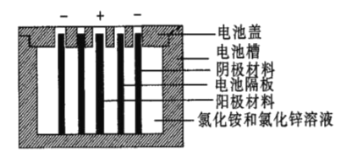
A.放电时,外电路每通过0.1NA个电子时,锌片的质量减少3.25g
B.充电时,聚苯胺电极的电势低于锌片的电势
C.放电时,混合液中的Cl-向负极移动
D.充电时,聚苯胺电极接电源的正极,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家航天局计划2020年实施火星探测任务。据了解火星上存在大量的含氮化合物科学家推测火星生命可能主要以氮、碳、硅、铜为基体构成。
(1)邻氨基吡啶(![]() )的铜配合物在有机不对称合成中起催化诱导效应。
)的铜配合物在有机不对称合成中起催化诱导效应。
①邻氨基吡啶中所有元素的电负性由小到大的顺序为__(填元素符号)。设NA为阿伏加德罗常数的值,1mol![]() 中含有σ键的数目为__。
中含有σ键的数目为__。
②一定条件下-NH2可以被氧化成-NO2,-NH2中N原子的杂化方式为__杂化。
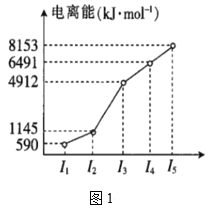
(2)第四周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素的基态原子电子排布式为___。
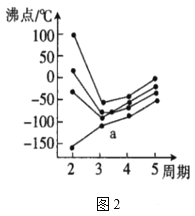
①嘌呤中轨道之间的夹角∠1比∠2大,原因是___。
②![]() 分子中的大π键可以用符号
分子中的大π键可以用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡啶中的大π键可表示为__。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡啶中的大π键可表示为__。
(3)火星岩石中存在大量的氮化镓,氮化镓为六方晶胞,结构如图3所示。
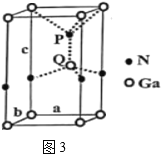
若该晶体密度为dg·cm-3,晶胞参数a=b≠c(单位:nm),a、b夹角为120o,阿伏加德罗常数的值为NA,则晶胞参数c=__(写出代数式)nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解结晶水合物CuCl·2H2O制备CuCl,并进行相关探究。
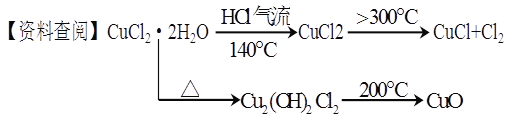
【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。

请回答下列问题:
(1)仪器X的名称是 。
(2)实验操作的先后顺序是![]()
![]() (填操作的编号)。
(填操作的编号)。
a.检查装置的气密性后加入药品
b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl
d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是 。
(4)装置D中发生的氧化还原反应的离子方程式是 。
【探究反思】
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是 。
②若杂质是CuO,则产生的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
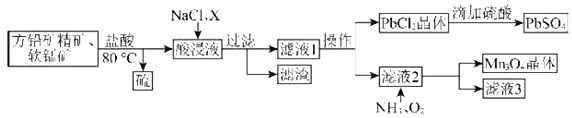
【题目】用方铅矿精矿(主要为![]() )和软锰矿(主要为
)和软锰矿(主要为![]() ,还有少量
,还有少量![]() 、
、![]() 等杂质)制备
等杂质)制备![]() 和
和![]() 的工艺流程如图:
的工艺流程如图:
已知:①![]() 。
。
②![]() 。
。
(1)80℃用盐酸处理两种矿石,为加快酸浸速率,还可采用的方法是____________(任写一种)。
(2)向酸浸液中加入饱和食盐水的目的是_____________;加入物质X可用于调节酸浸液的![]() 值,物质X可以是___________(填字母)。
值,物质X可以是___________(填字母)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(3)滤渣中含有两种金属杂质形成的化合物,其成分为___________(写化学式)。
(4)向滤液2中通入![]() 和
和![]() 发生反应,写出总反应的离子方程式:________________。
发生反应,写出总反应的离子方程式:________________。
(5)用![]() 为原料可以获得金属锰,合适的冶炼方法为____________(填字母)。
为原料可以获得金属锰,合适的冶炼方法为____________(填字母)。
A.热还原法 B.电解法 C.热分解法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com