
| A���٢ܢޡ� | B���٢ڢۢܡ� | C���٢ܢݢޡ� | D��ȫ�� |


 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ���� | HF | H3PO4 |
| ����ƽ �ⳣ�� | K= 3.6��10��4 | K1=" " 7.5��10��3 K2=" " 6.2��10��8 K3=" " 2.2��10��13 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 H+��OH������H��0��������������ȷ����
H+��OH������H��0��������������ȷ����| A����ˮ���ȣ�pH��С |
| B�������£���ˮ�м�����������KOH��Kw���� |
| C����ˮ�е���ϡ���ᣬc(H+)���� |
| D����ˮ�м�����������NaClO��ƽ�������ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ʪ���pH��ֽ�ⶨ������Һ��pHʱ����ˮ�������� |
| B������Ϻ���Һǡ�ó�����ʱ��c(Cl��)�� c(NH4+)�� c(NH3��H2O) |
| C������Һ��������ʱ����ַ�Ӧ��c(Cl��)> c(NH4+)> c(OH��)> c(H+) |
| D��ǡ�÷�Ӧ������ʱ�����谱ˮ����������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������1 mol NH3����? | B����NH3��NH ֮��Ϊ1 mol? ֮��Ϊ1 mol? |
| C����NH3·H2O 1 mol? | D����NH3��NH3·H2O��NH ֮��Ϊ1 mol ֮��Ϊ1 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
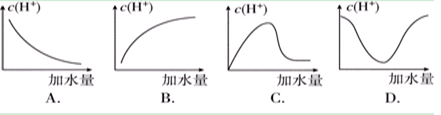
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ˮ�����c(H��)����=��=��=�� |
| B�����ڡ�����Һ��Ϻ�pH=7����������Һ���������=�� |
| C��������Ģ١��ڡ�����Һ�ֱ����������۷�Ӧ������H2����������� |
| D������Һ�м���100mLˮ����Һ��pH���ۣ��ܣ��٣��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ʵ������¶ȣ�CH3COOH�ĵ���̶ȼ�С |
| B��������NaOH���壬CH3COOH �ĵ���ƽ�����������ƶ� |
| C��������0.1mol/L��HCl��Һ����Һ��c(H+)����ƽ�����������ƶ� |
| D��������CH3COONa���壬CH3COOH �ĵ���ƽ��ƽ�����������ƶ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com