
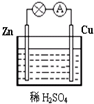
 (1)Zn极为原电池的负(填“正”或“负”)极,该极的电极反应式是Zn-2e-=Zn2+,属于氧化反应(填“氧化反应”或“还原反应”).Cu极的电极反应式是2H++2e-=H2↑,
(1)Zn极为原电池的负(填“正”或“负”)极,该极的电极反应式是Zn-2e-=Zn2+,属于氧化反应(填“氧化反应”或“还原反应”).Cu极的电极反应式是2H++2e-=H2↑,分析 (1)锌铜原电池依据装置图分析,锌做负极失电子发生氧化反应生成锌离子;
(2)铜做正极,溶液中氢离子得到电子生成氢气,发生还原反应,电子流向从负极沿导线流向正极,溶液中阳离子移向正极;
(3)据正极电极反应式2H++2e-=H2↑计算.
解答 解:(1)锌铜原电池依据装置图分析,锌做负极失电子发生氧化反应生成锌离子,负极发生的反应是Zn-2e-=Zn2+,Cu为正极,氢离子在正极上得电子发生还原反应生成氢气,电极反应式为2H++2e-=H2↑,
故答案为:负;Zn-2e-=Zn2+;氧化反应;2H++2e-=H2↑;
(2)该原电池反应原理是Zn+2H+═Zn2++H2↑,铜做正极,电子流向从负极沿导线流向正极,溶液中阳离子移向正极;
故答案为:Zn+2H+═Zn2++H2↑; 电子; 铜片;
(3)正极电极反应式2H++2e-=H2↑,有1mol电子通过时,生成0.5mol氢气,质量为1g,故答案为:1.
点评 本题考查了原电池原理的分析应用主要是电极反应,电极判断,电子流向,掌握基础是关键,题目较简单.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 质子数:c>b | B. | 氢化物的稳定性:H2Y<HZ | ||
| C. | 离子的还原性:Y2-<Z- | D. | 原子半径:r(X)<r(W) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中的能量变化均表现为热量的变化 | |
| B. | 化学键的断裂和形成是化学反应中的能量变化的主要原因 | |
| C. | 需要加热才能够发生的反应一定是吸热反应 | |
| D. | 在一个确定的化学反应过程中,反应物的总能量总是高于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 降低温度 | C. | 使用催化剂 | D. | 增大CO浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2molSO2(g)和1molO2(g)所具有的内能小于2molSO3(g)所具有的内能 | |
| B. | 将2molSO2(g)、1molO2(g)置于一密闭容器中充分反应后放出QkJ的热量 | |
| C. | 升高温度,平衡向逆反应移动,上述热化学方程式中的Q值减小 | |
| D. | 如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,则此过程中有2molSO2(g)被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com