
| 编号 | ① | ② | ③ | ④ |
| 硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9.6 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
分析 由表中数据可知,实验①②都有金属剩余,则溶液中不可能含有硝酸铁,溶液中金属离子为+2价,在实验①的基础上加入100mL硝酸,参加反应的金属的质量为18g-9.6g=8.4g,
生成NO的体积为4480mL-2240mL=2240mL,NO物质的量为0.1mol,
根据电子转移守恒可知,参加反应金属的物质的量为$\frac{0.1mol×(5-2)}{2}$=0.15mol,
参加反应金属的平均摩尔质量为$\frac{8.4g}{0.15mol}$=56g/mol,
故该过程只有Fe参加反应,故实验①只有Fe参与反应,
根据NO的体积结合方程式计算硝酸的物质的量、参加反应Fe的物质的量,
根据c=$\frac{n}{V}$计算硝酸的物质的量浓度;
在实验②的基础上加入100mL硝酸,参加反应的金属的质量为9.6g,生成NO的体积为6720mL-4480mL=2240mL,NO物质的量为0.1mol,
若该过程只有Cu参加反应,根据电子转移守恒,
则Cu的物质的量=$\frac{0.1mol×(5-2)}{2}$═0.15mol,Cu的质量=0.15mol×64g/mol=9.6g,等于参加反应金属的质量,
故该过程只有Cu反应,且Cu恰好完全反应,
故加入200mL硝酸时,Fe恰好反应生成硝酸亚铁,在实验③的基础上再加入100mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,
根据亚铁离子的物质的量,利用电子转移守恒计算该阶段生成NO的物质的量,再根据V=nVm计算该阶段生成NO的体积,进而计算V的值;
②中溶解的金属为①中溶解的Fe与在①的基础上加入100mL硝酸溶解的金属的质量之和;
每份金属混合物为①中溶解的Fe与实验①剩余的金属的质量之和.
解答 解:由表中数据可知,实验①②都有金属剩余,则溶液中不可能含有硝酸铁,溶液中金属离子为+2价,在实验①的基础上加入100mL硝酸,参加反应的金属的质量为18g-9.6g=8.4g,
生成NO的体积为4480mL-2240mL=2240mL,NO物质的量为0.1mol,
根据电子转移守恒可知,参加反应金属的物质的量为=$\frac{0.1mol×(5-2)}{2}$=0.15mol,
参加反应金属的平均摩尔质量为$\frac{8.4g}{0.15mol}$=56g/mol;
故该过程只有Fe参加反应,故实验①只有Fe参与反应;
在实验②的基础上加入100mL硝酸,参加反应的金属的质量为9.6g,生成NO的体积为6720mL-4480mL=2240mL,NO物质的量为0.1mol,
若该过程只有Cu参加反应,根据电子转移守恒,
则Cu的物质的量═$\frac{0.1mol×(5-2)}{2}$=0.15mol,Cu的质量=0.15mol×64g/mol=9.6g,等于参加反应金属的质量,
故该过程只有Cu反应,且Cu恰好完全反应,
故加入200mL硝酸时,F好反应生成硝酸亚铁,在实验③的基础上再加入100mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,
①由上述分析可知,实验①发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,生成NO的物质的量为0.1mol,
根据方程式可知,参加反应的Fe的物质的量为0.1mol×$\frac{3}{2}$=0.15mol,
故参加反应Fe的质量=0.15mol×56g/mol=8.4g,在实验①的基础上加入100mL硝酸,参加反应的金属的质量为18g-9.6g=8.4g,
故实验②共溶解金属质量为8.4g+8.4g=16.8g,
故答案为:16.8g;
②由上述分析可知,实验①发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,生成NO的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,
根据方程式可知,参加反应的硝酸的物质的量为0.1mol×4=0.4mol,
故硝酸的物质的量浓度=$\frac{0.4mol}{0.1L}$=4mol/L,
故答案为:4;
③由上述分析可知,实验②中Fe与硝酸恰好反应生成硝酸亚铁,生成NO的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,
由3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O可知,溶液中亚铁离子的物质的量为0.3mol,在实验③的基础上再加入100mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,
根据电子转移守恒可知,生成NO的物质的量=$\frac{0.3mol×(3-2)}{5-2}$=0.1mol,
故生成NO的体积为0.1mol×22.4L/mol=2.24L=2240mL,
故V=6720+2240=8960,
故答案为:8960.
点评 本题考查混合物的有关计算,根据表中数据判断各阶段发生的反应是关键,侧重对学生综合能力的考查,过程复杂、计算量较大,为易错题目,难度较大.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:选择题
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
| A. | 根据表中数据不能计算出混合物中NaHCO3的质量 | |
| B. | 根据表中数据可救出盐酸的物质的量浓度为3mol•L-1 | |
| C. | 加入混合物9.2 g时恰好与盐酸完全反应 | |
| D. | 15.7 g混合物恰好与盐酸完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
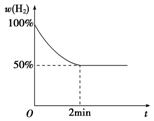 钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用.
钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
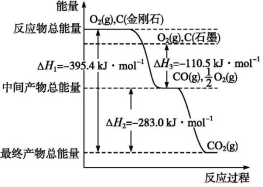 (1)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知:
(1)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低碳生活就是倡导低污染,低消耗,减少温室气体的排放 | |
| B. | 食用醋、医疗酒精、肥皂水三种溶液的pH逐渐增大 | |
| C. | 用活性炭为糖浆脱色和用臭氧漂白纸浆,二者所用原理相同 | |
| D. | 久置的植物油会严生难闻的特殊气味,是由于植物油发生了变质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com