
【题目】下列说法错误的是( )
A. 从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B. 1mol碳化硅晶体中,平均含有4mol C—Si共价键
C. 水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键
D. 某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE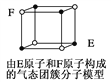
【答案】D
【解析】A.根据中心原子形成的价层电子对数判断;B.利用均摊法判断;C.氢键的作用力大于普通分子间作用力;D.团簇分子中含有4个E原子和4个F原子。
A. PH4+、PO43-中都形成4个σ键且孤电子对数均为0,则二者均为正四面体结构,故A正确;
B.碳化硅晶体中,每个C原子与4个Si原子形成共价键,则1mol碳化硅晶体中,平均含有4mol C—Si共价键,故B正确;
C.氢键的作用力大于普通分子间作用力,H2O分子间存在氢键,H2S分子间不能形成氢键,导致水的沸点比硫化氢的高,故C正确;
D.团簇分子中含有4个E原子和4个F原子,分子式应为E4F4或F4E4,故D错误;答案选D。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 煤矿内瓦斯、煤气、油田气中都含有甲烷
B. 农村沼气池产生的可燃气体是甲烷
C. 煤矿坑气是植物残体经微生物发酵而产生
D. 甲烷是天然气的主要成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有amol FeBr2的溶液中,通入xmol Cl2.下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A. x=0.4a,2Fe2++Cl2=2Fe3++2Cl﹣
B. x=a,2Fe2++2Br﹣+2Cl2=Br2+2Fe3++4Cl﹣
C. x=0.6a,2Br﹣+Cl2=Br2+2Cl﹣
D. x=1.5a,2Fe2++4Br﹣+3Cl2=2Br2+2Fe3++6Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们在学习和生活过程中所观察的以下现象与电化腐蚀有关的是
A. 光亮的自行车钢圈不易生锈
B. 炒过菜的铁锅未及时洗净出现红褐色锈斑
C. 光亮的铜丝在火焰上灼烧后变黑
D. 实验室镁带拆封放置一段时间后表面变灰暗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化硼是一种超硬耐磨涂层材料,右图为其晶胞,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是( )

A. 磷化硼晶体的熔点很低
B. 磷化硼晶体的化学式为BP,属于离子晶体
C. 磷化硼晶体中每个原子均形成4条共价键
D. 磷化硼晶体结构中微粒的空间堆积方式与氯化钠相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子结构与元素周期表、元素性质三者关系密切。
A、B、D、E、F为原子序数依次增大的前四周期元素,其中A的最外层电子数是其内层电子数的2倍,B、D、E为同周期元素,B原子的核外电子总数是其未成对电子数的5倍,E原子最外层有1个未成对电子,F原子核外有22种运动状态的电子。
请回答下列问题:
(1)F元素位于周期表_____________区,其价电子排布图为:_____________。
(2)B、D、E三种元素中,第一电离能最小的是_____________ (填元素符号);写出AD2的等电子体_____________ (分子和阴离子各写一种)。
(3)AO2和DO2熔点高的是_____________,原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于烷烃的叙述不正确的是( )
A. 烷烃只含有碳、氢两种元素
B. 含有碳、氢元素的烃不一定是烷烃
C. 烷烃一定是饱和烃,饱和烃不一定是烷烃
D. 碳原子间只以单键相结合的烃一定是烷烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 多年前,一艘载着天然苏打晶体(Na2CO3·10H2O)的商船在航行中搁浅,船员们便在附近的沙滩上用几块苏打晶体支锅煮饭。之后他们惊奇地发现,在苏打与沙粒接触的地方出现了许多晶莹发亮的珠子。回答下列问题:
(1)沙滩上沙粒的主要成分为_______(填化学式)。
(2)上述晶莹发亮的珠子可能是______(填字母)。
A. 水晶颗粒 B.无水碳酸钠 C.晶体硅 D.玻璃珠
(3)生成该珠子时发生反应的化学方程式为_____________。
(4)氢氟酸常用作玻璃的蚀刻剂,原因是______________(用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com