
分析 由反应物和生成物可写出反应的化学方程式为3NF3+5H2O=2NO+HNO3+9HF,反应中只有N元素的化合价发生变化,则氧化剂和还原剂都是NF3,NO易与空气中氧气反应生成红棕色的NO2气体,反应物可用碱液吸收,据此分析解答.
解答 解:(1)NF3→NO,化合价降低1价,被还原,则NO为还原产物,NF3→HNO3,化合价升高2价,被氧化,则HNO3为氧化产物,氧化还原反应中氧化剂和还原剂得失电子数目相等,则被氧化与被还原的元素的物质的量之比为1:2,故答案为:HNO3;1:2;
(2)由反应物和生成物可写出反应的化学方程式为3NF3+5H2O=2NO+HNO3+9HF,
由方程式可知若反应中生成0.2mol HNO3,转移的电子的物质的量为0.2mol×(5-3)=0.4mol,转移的电子数目为0.4NA个,
故答案为:3NF3+5H2O=2NO+HNO3+9HF;0.4NA;
(3)由4NH3+3F2=NF3+3NH4F可知氧化性F2>NF3,由3NF3+5H2O=2NO+HNO3+9HF可知氧化性NF3>NO,则氧化性F2>NF3>NO,故答案为:F2>NF3>NO;
(4)NO易与空气中氧气反应生成红棕色的NO2气体,同时生成的HF和HNO3易结合空气中的水蒸气形成酸雾,有刺激性气味,
故答案为:产生红棕色气体,产生刺激性气味气体,产生白雾;
(5)NF3与H2O反应产生HNO3,HNO3和NaOH反应必生成NaNO3,故答案为:NaNO3.
点评 本题考查含氮化合物的性质以及氧化还原反应,题目难度中等,注意从化合价变化的角度分析氧化还原反应的有关概念和计算,注意把握题给信息,为解答该题的关键.


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:选择题
| A. | 锌锰电池和碱性锌锰电池的正极材料均是锌 | |
| B. | 锌锰电池中电解质主要是NH4Cl,而碱性锌锰电池中的电解质主要是KOH | |
| C. | 碱性锌锰电池不如锌锰电池的寿命长 | |
| D. | 干电池放电之后还可再充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 重氢原子:${\;}_{1}^{2}$D | |
| B. | S2-的结构示意图: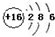 | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | N2的电子式: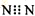 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油是不可再生能源,天然气是可再生能源 | |
| B. | 在化学反应中,反应物转化为生成物的同时,必然发生能量的变化 | |
| C. | 热值指在一定条件下,1mol的物质完全燃烧所放出的热量 | |
| D. | 若化学过程中断开化学键放出的能量大于形成化学键所吸收的能量,则反应放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中氢气作还原剂,铝作氧化剂 | B. | B2H6充分燃烧生成B2O3和H2O | ||
| C. | B2H6中存在共价键和离子键 | D. | 每生成1molB2H6转移3mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 天然气、太阳能、生物质能、风能、氢能均属于新能源 | |
| C. | 自发反应的熵一定增大,非自发反应的熵一定减小 | |
| D. | 常温下,反应C(s)+CO2(g)?2CO(g)不能自发进行,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
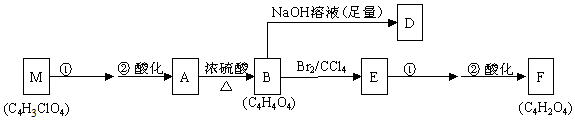
 +(2n-1)H2O .
+(2n-1)H2O . .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com