
分析 某银白色金属单质A在空气中加热燃烧时发出黄色火焰,则A是Na,得到淡黄色固体B,钠在空气燃烧生成淡黄色固体过氧化钠,则B是Na2O2,钠露置在空气中足够长时间变为Na2CO3,所以C是Na2CO3,过氧化钠和酸性气体D反应生成Na2CO3,则D是CO2,E和二氧化碳反应也生成Na2CO3,钠、过氧化钠和水反应都生成氢氧化钠,则E是NaOH,结合物质的性质分析解答.
解答 解:某银白色金属单质A在空气中加热燃烧时发出黄色火焰,则A是Na,得到淡黄色固体B,钠在空气燃烧生成淡黄色固体过氧化钠,则B是Na2O2,钠露置在空气中足够长时间变为Na2CO3,所以C是Na2CO3,过氧化钠和酸性气体D反应生成Na2CO3,则D是CO2,E和二氧化碳反应也生成Na2CO3,钠、过氧化钠和水反应都生成氢氧化钠,则E是NaOH,
(1)通过以上分析知,A、B、C、D、E分别是Na、Na2O2、Na2CO3、CO2、NaOH,
故答案为:Na2CO3、CO2、NaOH;
(2)①A是钠,与水反应的化学方程式为:2Na+2H2O═2NaOH+H2↑,故答案为:2Na+2H2O═2NaOH+H2↑;
②B是过氧化钠,D是二氧化碳,过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为:2Na2O2+2CO2═2Na2CO3+O2,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;(12分)、(1)(3分)Na2CO3、C O2、NaOH
③E是氧化钠与少量二氧化碳反应的离子方程式CO2+2OH-═CO32-+H2O,故答案为:CO2+2OH-═CO32-+H2O.
点评 本题考查了钠及其化合物之间的转化,明确钠及其化合物的性质是解本题关键,以“A的颜色及焰色反应、B的颜色”为突破口来分析解答,注意钠放置在空气中很长时间后最终变为碳酸钠,难度不大.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气有毒,不可用于自来水的杀菌消毒 | |
| B. | Al(OH)3受热分解生成H2O并吸收大量的热量,可用作阻燃剂 | |
| C. | 二氧化硅不与强酸反应,可用玻璃容器盛放氢氟酸 | |
| D. | Na2O2具有强氧化性,可用作呼吸面具的供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种元素的原子序数依次递增.已知:
A、B、C、D、E、F六种元素的原子序数依次递增.已知:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
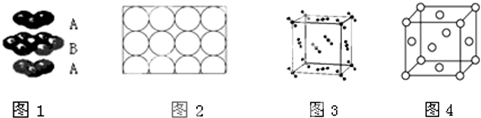
| A. | 钛和钾都采取图1的堆积方式 | |
| B. | 图2为金属原子在二维空间里的非密置层放置,此方式在三维空间里堆积,仅得简单立方堆积 | |
| C. | 图3是干冰晶体的晶胞,晶胞棱长为a cm,则在每个CO2周围最近且等距离的CO2有8个 | |
| D. | 图4是一种金属晶体的晶胞,它是金属原子在三维空间以密置层采取ABCABC…堆积的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com