
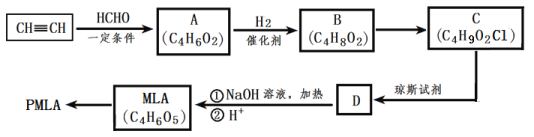
【题目】聚苹果酸(PMLA),是一种生物医学材料,可由苹果酸(MLA)经聚合反应生成。PMLA的一种合成路线如图所示。
已知:①R1-C![]() CH+
CH+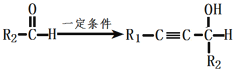
②R-CH2OH![]() R-COOH
R-COOH
(1)A中含有官能团名称为___、___。
(2)B到C的反应类型为___反应。
(3)B的核磁氢谱中有三组峰,其峰面积比为1:1:2,B的结构简式为___。
(4)D与NaOH溶液在加热条件下反应的化学方程式为___。
(5)上述转化关系中B→C和C→D这两步的顺序能否颠倒___(填“能”或“不能”),理由是___。
(6)写出与MLA具有相同官能团的所有同分异构体的结构简式___(不包含MLA)。
(7)聚酯PMLA有多种结构,写出由MLA制PMLA的化学方程式___(任写一种)。
【答案】羟基 碳碳三键 加成 HO-CH2CH=CHCH2-OH ![]() +3NaOH
+3NaOH![]() +NaCl+2H2O 不能 若先氧化则B中碳碳双键也被氧化
+NaCl+2H2O 不能 若先氧化则B中碳碳双键也被氧化 ![]() 、
、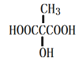 n
n +(n-1)H2O
+(n-1)H2O
【解析】
由A的分子式、结合信息,可知1分子甲醛与2分子乙炔发生加成反应生成A,则A的结构简式为HOCH2C≡CCH2OH,A与氢气发生加成反应生成B为HOCH2CH=CHCH2OH,B在一定条件下与HCl发生加成反应生成C,C为HOCH2CH2CH(Cl)CH2OH,根据已知信息②R-CH2OH![]() R-COOH,则C与琼斯试剂发生氧化反应生成D,D为HOOCCH2CH(Cl)COOH,D在氢氧化钠水溶液、加热条件下发生反应生成
R-COOH,则C与琼斯试剂发生氧化反应生成D,D为HOOCCH2CH(Cl)COOH,D在氢氧化钠水溶液、加热条件下发生反应生成![]() ,再加酸酸化制得MLA为
,再加酸酸化制得MLA为![]() ,可由苹果酸(MLA)经聚合反应生成PMLA,据此分析解答。
,可由苹果酸(MLA)经聚合反应生成PMLA,据此分析解答。
(1)A的结构简式为HOCH2C≡CCH2OH,含有官能团的名称是:羟基、碳碳三键;
(2)B为HOCH2CH=CHCH2OH,B在一定条件下与HCl发生加成反应生成C,B到C的反应类型为加成反应;
(3)B的核磁氢谱中有三组峰,其峰面积比为1:1:2,B的结构简式为HO-CH2CH=CHCH2-OH;
(4)D为HOOCCH2CH(Cl)COOH,结构中有羧基和氯原子,都可与氢氧化钠发生反应,D在氢氧化钠水溶液、加热条件下发生反应生成![]() ,化学方程式为
,化学方程式为![]() +3NaOH
+3NaOH![]() +NaCl+2H2O;
+NaCl+2H2O;
(5)C与琼斯试剂发生氧化反应生成D,B为HOCH2CH=CHCH2OH,结构中含有碳碳双键,若先发生氧化反应,则B中碳碳双键也被氧化,因此不能颠倒;
(6)MLA为![]() ,与MLA具有相同官能团的所有同分异构体的结构简式
,与MLA具有相同官能团的所有同分异构体的结构简式![]() 、
、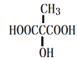 ;
;
(7)聚酯PMLA有多种结构,由MLA制PMLA发生脱水缩合反应,可以为分子内缩合,也可分子间缩合,其中一种缩合反应的化学方程式n +(n-1)H2O。
+(n-1)H2O。


科目:高中化学 来源: 题型:
【题目】2019年10月1日,在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态铁原子的价电子排布式为___。
(2)与Cr同周期且基态原子最外层电子数相同的元素,可能位于周期表的___区。
(3)实验室常用KSCN溶液、苯酚(![]() )检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为___(用元素符号表示),苯酚中碳原子的杂化轨道类型为___。
)检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为___(用元素符号表示),苯酚中碳原子的杂化轨道类型为___。
(4)铁元素能于CO形成Fe(CO)5。羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1mol Fe(CO)5分子中含___molσ键,与CO互为等电子体的一种离子的化学式为___。
(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的___空隙和___空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B(![]() ,0,
,0,![]() ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
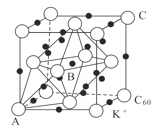
(6)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为___,晶胞参数为428pm,则晶体密度为___g/cm3(NA表示阿伏加德罗常数的值,列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对实验Ⅰ~Ⅳ的实验现象预测正确的是


A.实验Ⅰ:液体分层,下层呈无色
B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C.实验Ⅲ:试管中有红色沉淀生成
D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.30gC2H6含共价键的数目为7NA
B.标准状况下,33.6LHF中含有氟原子的数目为1.5NA
C.0.1mol/L氨水中含有OH-的数目为0.1NA
D.一定条件下,0.1molN2与足量H2反应生成NH3,转移电子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、NO、NO2、SO2都是大气污染物,减少这些氧化物排放对于环境保护具有重要的意义。
已知下列热化学方程式
C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
N2(g)+2O2(g)=2NO2(g) ΔH2=+68kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH3=-221.0kJ·mol-1
(1)2NO2(g)+4CO(g)=4CO2(g)+N2(g)ΔH=__kJ·mol-1。
①某温度下,在2L密闭容器中充入0.4mo1CO和0.6molNO2,此时容器的压强为2.0×105Pa,5s时,容器的压强变为原来的0.95倍,则从反应开始到5秒末NO2的平均反应速率v(NO2)=__mol/(L·s)。
②下列能使该反应的反应速率增大,且平衡向正反应方向移动的是__。
A.适当升高温度
B.减小容器体积使体系压强增大
C.及时分离出CO2
D.向密闭容器中再充入0.4molNO2
(2)某温度下,下列反应的平衡常数如下:
a.2NO2(g)N2(g)+2O2(g) K1=7.0×1016
b.2NO(g)N2(g)+O2(g) K2=2.1×1030
反应2NO(g)+O2(g)2NO2(g)的平衡常数K3=__。
(3)在催化剂作用下用CO还原NO2进行尾气处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成N2的物质的量与时间变化如图a。活化能最小的是_(用E(A)、E(B)、E(C)表示三种催化剂下该反应活化能)。

②在催化剂B作用下,测得相同时间内,处理NO2的量与温度的关系如图b。图中曲线先增大后减小,请说明后减小的原因___(假设该温度范围内催化效率相同)。

(4)煤燃烧产生的SO2用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可以制备H2SO4,其原理如图c所示(电极材料为石墨)。a电极反应式为__。b为_(阴、阳)极,d离子交换膜为__(阴、阳)离子交换膜。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物C10H10O2有如图的转化关系:
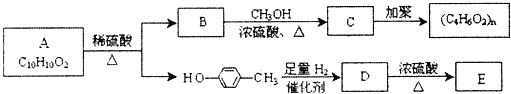
已知:E能使Br2的CCl4溶液褪色。请回答下列问题:
(1)分别写出A、C和E的结构简式:A:__;C:__;E:__。
(2)若有机物F与C互为同分异构体,则与有机物B互为同系物的F的同分异构体有__种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁、铝合金投入100mL一定物质的量浓度的盐酸中,使合金全部溶解。向所得溶液中滴加5mol/L NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液体积的关系如图曲线所示。则盐酸的物质的量浓度为( )

A.1mol/LB.8mol/LC.10mol/LD.12mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。下列说法错误的是
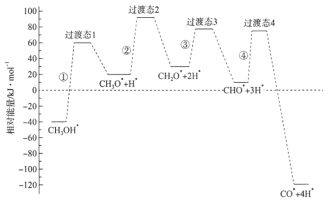
A.②中包含C—H键的断裂过程
B.该历程中能垒(反应活化能)最小的是③
C.该历程中制约反应速率的方程式为CH3O*+3H* CO*+4H*
D.由此历程可知:![]() △H<0
△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在Fe2+检验实验中观察到异常现象,为探究“红色褪去”的原因,进行如下实验:
编号 | 实验I | 实验II | 实验III |
实验步骤 |
| 将实验I褪色后的溶液分三份分别进行实验
| 为进一步探究“红色褪去”的原因,又进行以下实验 ① ②取反应后的溶液,滴加盐酸和BaCl2溶液 |
现象 | 溶液先变红,片刻后红色褪去,有气体生成(经检验为O2) | ①无明显现象 ②溶液变红 ③产生白色沉淀 | ①溶液变红,一段时间后不褪色。 ②无白色沉淀产生 |
分析上述三个实验,下列叙述不正确的是
A.在此实验条件下H2O2氧化Fe2+的速率比氧化SCN-的速率快
B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于SCN-被氧化
C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去只与H2O2的氧化性有关
D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理无关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com