
常温下,有下列四种溶液:
|
① |
② |
③ |
④ |
|
0.1mol/L NH3·H2O溶液 |
pH=11 NaOH溶液 |
pH=1 H2SO4溶液 |
pH=3 CH3COOH溶液 |
下列说法正确的是( )
A.①与③等体积混合,溶液pH<7
B.②与④等体积混合,溶液pH>7
C.将VmL④的溶液浓缩到10—2VmL后,pH与③相同
D.②与③混合,若溶液pH=7,则V(NaOH) : V(H2SO4) =100 : 1
AD
【解析】
试题分析: ①与③等体积混合,则酸碱恰好完全反应,生成硫酸铵溶液,硫酸铵水解呈酸性,所以pH<7,所以A正确;②与④等体积混合,由于醋酸的浓度未知,所以所得溶液不可确定,所以pH不确定,B错误;④的溶液为弱酸溶液,浓缩100倍后,不考虑电离程度改变,H+浓度增大100倍,pH=1,但是浓度增大,醋酸的电离程度减小,所以H+浓度增大小于100倍,pH<1,C错误;②与③分别为强碱、强酸溶液,C(OH-):C(H+)=1:100,所以若二者混合后溶液呈中性,则体积比为V(NaOH) : V(H2SO4) =100 : 1,D正确;故选AD。
考点:本题考查的是酸碱混合计算PH值。


科目:高中化学 来源: 题型:





 +NaHCO3→
+NaHCO3→ +CO2↑+H2O
+CO2↑+H2O +NaHCO3→
+NaHCO3→ +CO2↑+H2O
+CO2↑+H2O

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质 结构 信息 |
单质制成的高压灯,发出的黄光透雾力强、射程远. | 工业上通过分离液态空气获得其单质.原子的最外层未达到稳定结构. | 单质常温、常压下是气体,原子的L层有一个未成对的p电子. | +2价阳离子的核外电子排布与氖原子相同. |
查看答案和解析>>
科目:高中化学 来源: 题型:
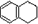 ,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
| △ |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
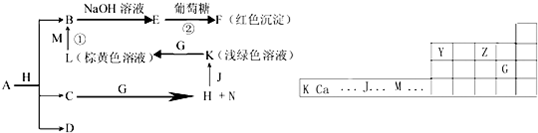
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com