
| c(I-)/mol•L-1 | c(Fe3+)/mol•L-1 | v/mol•L-1•s-1 | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
分析 (1)加入CCl4萃取了I2,减小了生成物浓度,反应速率降低,从而使得v(正)>v(逆),导致平衡向右移动;
(2)将表中的三组数据代入公式v=k[c(I-)]m•[c(Fe3+)]n得m和n的值.
解答 解:(1)加入CCl4萃取了I2,减小了生成物浓度,反应速率降低,从而使得v(正)>v(逆),导致平衡向右移动,
故答案为:减慢;>;
(2)将表中的三组数据代入公式v=k[c(I-)]m•[c(Fe3+)]n
得0.20m×0.80n=0.032K,
0.60m×0.40n=0.144K,
0.80m×0.20n=0.128K,
解之得:m=2,n=1,
所以I-浓度对反应速率的影响大,
故答案为:C;大于.
点评 本题考查了了化学平衡常数、反应速率概念的计算,注意对表格中数据的处理,掌握基础是关键,题目难度中等.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中旧键断裂吸收的总能量大于新键形成放出的总能量 | |
| B. | 反应物的总能量高于生成物的总能量 | |
| C. | 该反应为放热反应 | |
| D. | 该反应的化学能可以转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期律是按相对原子质量逐渐增大的顺序从左到右排列的 | |
| B. | 最外层电子数相同的元素都是同一族 | |
| C. | 同周期元素原子的电子层数相同数一定相同 | |
| D. | 非金属元素的最外层电子数都大于或等于4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 淀粉溶液、乙醇、苯、四氯化碳 | B. | 乙烯、乙烷、乙炔、丙烯 | ||
| C. | 甲酸、乙醛、乙醇、乙酸 | D. | 苯酚、溴苯、苯、甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
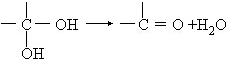
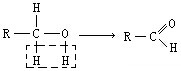
 (在方框中填写有机物的结构简式,说明加氧氧化)
(在方框中填写有机物的结构简式,说明加氧氧化)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com